1、选择题 在同温同压下,下列各组热化学方程式中,Q2>Q1的是( )
A.2H2(气)+O2(气)=2H2O(气)+Q1 2H2(气)+O2(气)=2H2O(液)+Q2
B.S(气)+O2(气)=SO2(气)+Q1 S(固)+O2(气)=SO2(气)+Q2
C.C(固)+
O2(气)=CO(气)+Q1 C(固)+O2(气)=CO2(气)+Q2
D.H2(气)+Cl2(气)=2HCl(气)+Q1 H2(气)+Cl2(气)=HCl(气)+Q2
参考答案:AC
本题解析:
本题难度:一般
2、选择题 使18g焦炭发生不完全燃烧,所得气体中CO占
体积,CO2占体积,已知:C(s)+O2(g)=CO(g);△H=-Q1kJ/mol,CO(g)+O2(g)=CO2(g);△H=-Q2kJ/mol,与这些焦炭完全燃烧相比较,损失的热量是( )
A.Q2?kJ
B.Q1kJ
C.Q2kJ
D.(Q1+Q2)kJ
参考答案:A
本题解析:
本题难度:一般
3、选择题 常温下amolFe恰好完全溶解在含bmolHNO3的某浓度硝酸溶液中,生成cmol的气体。若已知Fe可溶于含Fe3+的溶液中:Fe+2Fe3+=3Fe2+,则下列情况不可能的是
A.产生红棕色气体,后产生无色气体,有cmolHNO3被还原
B.a与c的比值在下列值之间:1∶3~3∶2
C.当b=2a+c时,b=4c;当b=3a+c时,b=4c
D.当2a+c
参考答案:AB
本题解析:常温下能与铁反应放出气体的硝酸溶液只可能是稀硝酸,放出的气体也不可能是NO2而是NO,因此,选项A明显错误。铁与稀硝酸反应的化学方程式为:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O;若铁过量,铁还能进一步与生成的硝酸铁反应,化学方程式变为:3Fe(过量)+8HNO3=3Fe(NO3)2+2NO↑+4H2O。根据上述反应方程式可知,B错误而C、D正确。
本题难度:一般
4、计算题 已知:C(s)+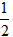 O2(g)=CO(g) △H=-110.5kJ/mol CO(g)+
O2(g)=CO(g) △H=-110.5kJ/mol CO(g)+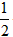 O2(g)=CO2(g) △H=-283.0kJ/mol 60 g C不完全燃烧,经分析得到的气体中:CO2占体积
O2(g)=CO2(g) △H=-283.0kJ/mol 60 g C不完全燃烧,经分析得到的气体中:CO2占体积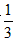 ,CO 占体积
,CO 占体积 ,则需要标准状况下的空气多少升?反应所放出的热量比完全燃烧时所放出的热量少多少?C的燃烧热为多少?
,则需要标准状况下的空气多少升?反应所放出的热量比完全燃烧时所放出的热量少多少?C的燃烧热为多少?
参考答案:需空气355.6 L,不完全燃烧少放出的热量为943.3 kJ;C的燃烧热为393.5 kJ/mol。
本题解析:
本题难度:一般
5、填空题 联氨(N2H4)及其衍生物是一类重要的火箭燃料,N2H4与N2O4反应能放出大量的热。
(1)已知:2NO2(g)=N2O4(g) △H=-57. 20 kJ/mol。一定温度下,在密闭容器中反应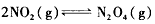 达到平衡。
达到平衡。
其他条件不变时,下列措施能提高NO2转化率的是_____________ (填字母)。
A.减小NO2的浓度 B.降低温度? C.增加NO2的浓度 D.升高温度
(2)25℃时,1 00 g N2H4(1)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14 kJ的热量。则反应2N2H4(1)+N2O4(1)=3N2(g) +4H2O(1)的△H=____kJ/mol
(3)17℃、1.01×l05Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2) =0. 030 0 mol/L、c(N2O4)=0.0120 mol/L。计算反应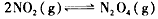 的平衡常数K。_______________________
的平衡常数K。_______________________
(4)现用一定量的Cu与足量的浓HNO3反应,制得1.00 L已达到平衡的N2O4和NO2的混合气体(17℃、1.01×105Pa),理论上至少需消耗Cu多少克?________________________________________
参考答案:(1)BC
(2) -1224.96
(3)根据题意知平衡时:c(N2O4)=0.012 0 mol/L c( NO2)=0.030 0 moI/L
答:平衡常数为13.3。
(4)由(3)可知,在17℃、1. 01×105 Pa达到平衡时,l.00 L 混合气体中:
n(N2O4)=c(N2O4)×V=0.0120 mol/L ×l.00L=0.0120 mol
n( NO2)=c( NO2)×v=0.0300 mol/L×l.00 L =0.0300 moI
则n总( NO2)=n(NO2) +2×n(N2O4)=0.0540 mol
由Cu+4HNO3=Cu(NO3)2+2NO2↑ +2H2O可得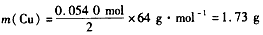
答:理论上至少需消耗Cu l.73 g。
本题解析:
本题难度:困难