| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《离子方程式的书写及正误判断》试题预测(2019年最新版)(十)
参考答案:C 本题解析:A.等物质的量MgCl2、Ba(OH)2和HCl溶液混合后首先发生中和反应,剩余的氢氧化钡再与氯化镁反应生成白色沉淀氢氧化镁,但反应后氯化镁过量,即:Mg2++4OH-+2H+=Mg(OH)2↓+2H2O,A错误;B.向NaAlO2溶液中通入过量CO2的反应AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,B错误;C.等物质的量的FeBr2与Cl2反应中氯气首先氧化亚铁离子,然后再氧化溴离子,其中溴离子过量,则反应可表示为2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-,C正确;D.浓盐酸也能被KMnO4溶液氧化生成氯气,应该用稀硫酸酸化,D不正确,答案选C。 本题难度:一般 4、选择题 下列离子方程式中正确的是 |
参考答案:A
本题解析:A、硫酸铜溶液中加入过量NaHS溶液,则铜离子与HS-发生双水解反应,生成CuS和硫化氢气体,正确;B、四氧化三铁与硝酸反应,则亚铁离子被氧化为铁离子,错误;C、碳酸氢铵与氢氧化钾共热,碳酸氢根离子也与氢氧根离子反应生成碳酸根离子和水,错误;D、二氧化硫与次氯酸钠反应,次氯酸钠具有强氧化性,所以应发生氧化还原反应,生成硫酸根离子和氯离子,错误,答案选A。
考点:考查离子方程式书写正误的判断
本题难度:一般
5、选择题 能正确表示下列反应的离子方程式是
A.向碳酸氢钙溶液中滴入过量澄清石灰水:Ca2++2HCO3—+2OH— =CaCO3↓+CO32—+2H2O
B.NH4HSO3溶液与足量的NaOH溶液混合加热:NH4++HSO3-+2OH- NH3?+SO32-+2H2O
NH3?+SO32-+2H2O
C.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至溶液呈中性: H++SO42-+Ba2++OH-=BaSO4↓+H2O
D.向KIO3与KI混合溶液中加入醋酸发生反应生成I2:IO3-+5I-+6H+=3I2+3H2O
参考答案:B
本题解析:A、向碳酸氢钙溶液中滴入过量澄清石灰水生成碳酸钙沉淀和水,离子方程式为Ca2++HCO3—+OH—=CaCO3↓+H2O,A错误;B、NH4HSO3溶液与足量的NaOH溶液混合加热生成亚硫酸钠、水和氨气,即NH4++HSO3-+2OH-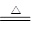 NH3↑+SO32-+2H2O,B正确;C、向NaHSO4溶液中逐滴加入Ba(OH)2溶液至溶液呈中性生成硫酸钡、硫酸钠和水,即2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,C错误;D、向KIO3与KI混合溶液中加入醋酸发生氧化还原反应生成I2,即IO3-+5I-+6CH3COOH=3I2+3H2O+6CH3COO-,D错误,答案选B。
NH3↑+SO32-+2H2O,B正确;C、向NaHSO4溶液中逐滴加入Ba(OH)2溶液至溶液呈中性生成硫酸钡、硫酸钠和水,即2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,C错误;D、向KIO3与KI混合溶液中加入醋酸发生氧化还原反应生成I2,即IO3-+5I-+6CH3COOH=3I2+3H2O+6CH3COO-,D错误,答案选B。
考点:考查离子方程式的正误判断
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点归纳《反应热计算.. | |