1、选择题 下列有关氧化还原反应的叙述中正确的是(?)
A.氧化还原反应的本质是元素化合价的变化
B.在氧化还原反应中,非金属单质一定作氧化剂
C.在置换反应中一定存在电子转移
D.某元素从化合态变为游离态时,该元素一定被还原
参考答案:C
本题解析:略
本题难度:简单
2、填空题 (6分)用双线桥法标出下列反应中电子转移的方向和数目:
MnO2 + 4HCl(浓)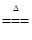 ?Cl2↑ + MnCl2 + 2H2O
?Cl2↑ + MnCl2 + 2H2O
其中,氧化剂是?,?元素被氧化。
参考答案:(6分)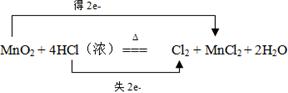 ?MnO2;Cl
?MnO2;Cl
本题解析:根据方程式可知,氯元素的化合价从-1价升高到0价失去1个电子,因此氯元素被氧化。锰元素的化合价从+4价降低到+2价,得到2个电子,所以二氧化锰是氧化剂。
点评:物质失去电子,所含元素化合价升高的做还原剂,反之得到电子,物质所含元素化合价降低的做氧化剂,据此可以进行有关判断。另外表示氧化还原反应的方法还可以是单线桥,注意区分二者。
本题难度:一般
3、填空题 (6分)写出298K时,下列反应的热化学方程式
(1)28 g CO还原Fe2O3生成单质铁,放出8.3 kJ热量;
(2)N2和O2化合生成184 g NO2气体,吸收热量135.4 kJ;
参考答案:(6分)
(1)3CO(g)+Fe2O3(s)==2 Fe(s)+3CO2(g) △H=-24.9 kJ·mol-1
Fe(s)+3CO2(g) △H=-24.9 kJ·mol-1
(2) N2(g)+ 2O2(g)==2NO2 (g) △H="+67.7" kJ·mol-1
(g) △H="+67.7" kJ·mol-1
本题解析:略
本题难度:一般
4、填空题 写出下列化学反应方程式:
(1)溴乙烷与NaOH的乙醇溶液共热:?。
(2)将CO2通入苯酚钠溶液中:?。
(3)1,3-丁二烯的与Br2的1、4加成反应:?。
(4)葡萄糖与银氨溶液发生银镜反应:?。
参考答案:
(1)CH3CH2Br + NaOH——→CH2=CH2↑+NaBr+H2O
(2)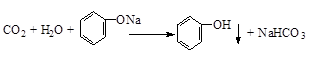
(3)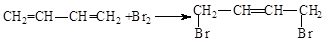
(4)CH2OH(CHOH)4CHO+2Ag(NH3)2OH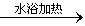 CH2OH(CHOH)4COONH4+2Ag↓+3NH3+H2O
CH2OH(CHOH)4COONH4+2Ag↓+3NH3+H2O
本题解析:
(1)NaOH醇溶液为消去反应的条件。
(2)该反应注意酸性H2CO3大于苯酚大于碳酸氢根;故产物为碳酸氢钠;
(3)该反应需要注意1,4加成;
(4)有机物的反应方程式一定要写其结构简式,展现它的官能团;有机物的反应其实就是分子中个别官能团的反应。对于葡萄糖的结构简式不懂,其实可由熟知的知识推导,由分子式C6H12C6为多羟基醛可得出。
本题难度:一般
5、填空题 (10分)铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(主要成分为FeS2)是生产硫酸和冶炼钢铁的重要原料。高温下可发生反应:
3FeS2+8O2 6SO2+Fe3O4
6SO2+Fe3O4
该过程中若有1.5mol FeS2参加反应,则反应过程中转移_____mol电子。
(2)氯化铁溶液显酸性,原因是___________________(用适当的文字和离子方程式解释),用惰性电极电解氯化铁溶液之初,阳极电极反应式为:____________________________________。
(3)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为:

放电时电池的负极反应式为____________________;充电时电解液的pH________(填“增大”“减小”或“不变”之一)。
参考答案:(每空2分,共10分) (1)16 (2)FeCl3电离出的Fe3+在水溶液中发生水解,使溶液显酸性。Fe3++3H2O Fe(OH)3+3H+ 2Cl--2e-=Cl2↑ Zn-2e-+2OH-=Zn(OH)2 减小
Fe(OH)3+3H+ 2Cl--2e-=Cl2↑ Zn-2e-+2OH-=Zn(OH)2 减小
本题解析:(1)根据方程式可知氧化剂只有氧气,消耗3molFeS2,转移8mol×4=32mol,所以该过程中若有1.5mol FeS2参加反应,则反应过程中转移16mol电子。
(2)铁离子水解,溶液显酸性离子方程式为Fe3++3H2O Fe(OH)3+3H+。用惰性电极电解氯化铁溶液之初,阳极失去电子,则溶液中的氯离子放电,则电极反应式为2Cl--2e-=Cl2↑。
Fe(OH)3+3H+。用惰性电极电解氯化铁溶液之初,阳极失去电子,则溶液中的氯离子放电,则电极反应式为2Cl--2e-=Cl2↑。
(3)根据方程式可知放电时锌是还原剂,作负极,因此放电时电池的负极反应式为Zn-2e-+2OH-=Zn(OH)2;电时消耗氢氧化钾,则电解液的pH减小。
考点:考查氧化还原反应以及电化学原理的应用
本题难度:一般