1、选择题 恒温条件下,把 装入带活塞的密闭容器中,当反应
装入带活塞的密闭容器中,当反应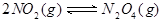 达到平衡后,慢慢压缩,下列叙述正确的是
达到平衡后,慢慢压缩,下列叙述正确的是
A.体积减半,则压强为原来的两倍
B.平衡向右移动,混合气体的颜色一定会变浅
C.体积减半,压强增大,但小于原来的2倍
D.平衡向右移动,混合气体密度不变
参考答案:C
本题解析:A错,体积减半,这个瞬间压强为原来的两倍,增大了压强,平衡向气体体积减小的方向移动,即该平衡将向正反应方向移动,压强在两倍的基础上将会减小;
B错,平衡向右移动混合气体的颜色不一定会变浅,如增加N2O4的浓度,平衡向左移动,但N2O4的浓度增大。
C,正确;D错,平衡向右移动,气体总物质的量减小,而气体的总质量不变,即,混合气体的密度会增大。
本题难度:一般
2、填空题 甲、乙两容器,甲的容积固定,乙的容积可变。在一定温度下,向甲中通入3mol N2和4mol H2,反应达到平衡时,生成NH3的物质的量为amol。
(1)相同温度下,向乙中通入2molNH3,且保持容积与甲相同,当反应达到平衡时,各物质的浓度与甲平衡中相同。起始时乙中还通入了____mol N2和____mol H2。
(2)相同温度下,若向乙中通入6mol N2和8mol H2,且保持压强与甲相等,当反应达到平衡时,生成氨的物质的量为b mol,则a∶b______1∶2;若乙与甲的容积始终相等,达到平衡时,生成氨的物质的量为c mol,则a∶c_____1∶2? (填“>”、“<”或“=”)。
参考答案:(1)2mol N2和1mol H2?(2)=?<
本题解析:(1)当反应达到平衡时,各物质的浓度与甲平衡中相同,说明平衡是等效的。乙中2mol氨气相当于是3mol氢气和1mol氮气。因此要使平衡等效,则还需要2mol N2和1mol H2。
(2)保持压强与甲相等,说明平衡是等温等压下的等效平衡,因此平衡时平衡氨的物质的量物质的量b=2a,所以a∶b=1∶2;由于氨的合成是压强减小的可逆反应,而乙能保持压强不变,所以乙中反应物的转化率大,即平衡时氨的物质的量物质的量c>2a,即a∶c<1∶2。
本题难度:一般
3、选择题 将一定量的Ag2SO4固体置于容积不变的容器中,在某温度下发生下列反应:
Ag2SO4(s) Ag2O(s)+SO3(g),2SO3(g)
Ag2O(s)+SO3(g),2SO3(g) 2SO2(g)+O2(g),经十分钟后,反应达到平衡,此时C(SO3)=0.4 mol/L,C(SO2)=0.1 mol/L,则下列叙述不正确的是
2SO2(g)+O2(g),经十分钟后,反应达到平衡,此时C(SO3)=0.4 mol/L,C(SO2)=0.1 mol/L,则下列叙述不正确的是
A.SO3的分解率为20%
B.平衡时,v(O2)=0.005 mol/(L·min)
C.容器内气体的密度为40g/L
D.加压,容器内固体质量不变
参考答案:D
本题解析:假设容器的容积为1L,容器内的SO2来SO3自的分解,根据方程式可知要生成SO2=0.1 mol,需要发生分解的SO3的0.1 mol,平衡时容器内的SO3有0.4mol,所以硫酸银分解生成的SO3总共有0.1+0.4="0.5mol," SO3的分解率为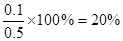 ,A正确,不选;平衡时
,A正确,不选;平衡时 根据速率之比等于计量数之比可以得到v(O2)=
根据速率之比等于计量数之比可以得到v(O2)= 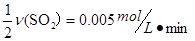 ,B正确,不选;根据方程式可知反应生成的氧气的物质的量为0.1mol,容器内气体的密度为
,B正确,不选;根据方程式可知反应生成的氧气的物质的量为0.1mol,容器内气体的密度为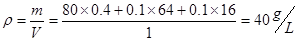 ,增大压强,两个化学平衡均向逆向移动,第一个平衡逆向移动,会导致固体的质量增大,气体质量减小,所以D错误,答案选D.
,增大压强,两个化学平衡均向逆向移动,第一个平衡逆向移动,会导致固体的质量增大,气体质量减小,所以D错误,答案选D.
本题难度:一般
4、填空题 (12分)汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g) + O2(g)  ?2NO(g)? △H > 0已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
?2NO(g)? △H > 0已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
(1)某温度下,向2L的密闭容器中充入N2和O2各1mol,5分钟后O2的物质的量为0.5 mol,则N2的反应速率?。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志?。
A.消耗1molN2同时生成1molO2
B.混合气体密度不变
C.混合气体平均相对分子质量不变
D.2V(N2)正=V(NO)逆
