1、选择题 一定温度条件下,在固定体积的密闭容器中发生反应A(s)+ 2B(g) C(g)+ D(g),能说明该反应达到平衡状态的标志是
C(g)+ D(g),能说明该反应达到平衡状态的标志是
A.平衡体系的总压不变
B.平衡混合气体的平均相对分子质量不变
C.C 和D的物质的量相等
D.平衡混合气体的总物质的量不变
参考答案:B
本题解析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。反应前后体积是不变的,因此压强和气体总的我知道始终是不变的,AD不正确。混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,物质的量不变,但质量是变化的,所以B可以说明。平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,C不正确,答案选B。
本题难度:一般
2、选择题 在一定温度下,2 L密闭容器内,反应2NO(g)+O2(g)  2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/min
| 0
| 1
| 2
| 3
| 4
| 5
|
n(NO))/mol
| 0.020
| 0.010
| 0.008
| 0.007
| 0.007
| 0.007
|
该反应达到平衡状态的时间是
A.3 min? B.1 min? C.2 min? D.0 min
参考答案:A
本题解析:根据表中数据可判断,反应进行到3min’时,NO的浓度不再发生变化,达到化学平衡状态,所以答案选A.
本题难度:简单
3、填空题 下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:

(1)已知该产业链中某反应的平衡常数表达式为:
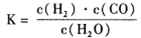
它所对应反应的化学方程式为_______。
已知在一定温度下,在同一平衡体系中各反应及平衡常数如下:
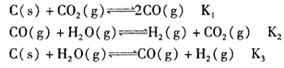
则K1、K2、K3之间的关系为_______。
(2)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应: , 该反应平衡常数随温度的变化如下:
, 该反应平衡常数随温度的变化如下:

该反应的逆反应方向是_______反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,反应达到平衡时CO的转化率为_______。
(3)甲醇是一种新型的汽车动力燃料,可通过CO和H2化合制备甲醇,该反应的热化学方程式为: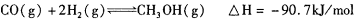
下列描述中能说明上述反应已达平衡的是_______;
A. 容器内气体的平均摩尔质量保持不变
B. 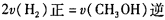
C. 容器中气体的压强保持不变
D. 单位时间内生成n molCO的同时生成2n mol H2
(4)甲醇-空气燃料电池(DMFC)是一种高效能、轻污 染电动汽车的车载电池,其工作原理如下图所示,该燃料电池的电池反应式为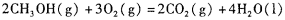 ,则负极的电极反应式为_______。
,则负极的电极反应式为_______。
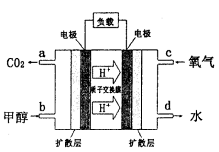
(5) CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其 。 CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀。现将CaCl2溶液与
。 CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀。现将CaCl2溶液与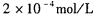 的Na2CO3溶液等体积混合,则生成沉淀时原CaCl2溶液的最小浓度为_______。
的Na2CO3溶液等体积混合,则生成沉淀时原CaCl2溶液的最小浓度为_______。
参考答案:(11分)(1)C(s)+H2O(g) CO(g)+H2(g)(1分); K3=K1?K2(1分);
CO(g)+H2(g)(1分); K3=K1?K2(1分);
(2)吸热(2分);? 75% (2分) ;?(3)A、C(2分);
(4)CH3OH-6e- +H2O=CO2+6H+?(1分)。
(5)5.6×10—5mo1/L (2分)
本题解析:(1)由平衡常数表达式分析得,所对应反应的化学方程式为C(s)+H2O(g) CO(g)+H2(g)。在同一平衡体系中,由化学方程式分析得,K3=K1?K2。
CO(g)+H2(g)。在同一平衡体系中,由化学方程式分析得,K3=K1?K2。
(2)由表中信息得,温度越大平衡常数越小,说明反应物的浓度逐渐增大,故反应为吸热反应。由化学方程式计算得反应达到平衡时CO的转化率为75%
(3)B项:正、逆反应速率之比不与化学计量数之比相等,故错;
D项:同为逆反应速率,故错。
故选AC。
(4)由化学方程式得,CH3OH是负极,故负极的电极反应式为CH3OH-6e- +H2O=CO2+6H+。
(5)由反应的化学方程式和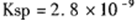 计算得,生成沉淀时原CaCl2溶液的最小浓度为5.6×10—5mo1/L。
计算得,生成沉淀时原CaCl2溶液的最小浓度为5.6×10—5mo1/L。
点评:本题考查的是煤的综合利用、化学平衡、燃料电池和溶解平衡的综合知识,题目难度大,考查学生对基础知识的掌握程度和分析问题、解决问题的能力。
本题难度:困难
4、填空题 在一个固定体积的密闭容器中,向容器中充入2 mol A 和1 mol B,发生如下反应:2A(g) + B(g)  3C(g) + D(s),反应达到平衡时C的浓度为1.2 mol/L.
3C(g) + D(s),反应达到平衡时C的浓度为1.2 mol/L.
(1)若使容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为________(填“吸热”或“放热”)反应.
(2)若维持容器体积和温度不变,按下列方法加入起始物质,达到平衡时C的浓度仍为1.2 mol/L的是______(用序号填空).
①4 mol A+2 mol B ②3 mol C+1 mol D+l mol B
③3 mol C+2 mol D ④1.6 mol A+0.8 mol B+0.6 mol C
(3)某温度下,向容器中加入3 mol C和0.8 mol D,反应达到平衡时C的浓度仍为1.2 mol/L,则容器的容积V应大于________L,小于________L.
参考答案:(4分) (1)吸热(1分) (2)③(1分) (3)0.5 2.5(2分)
本题解析:(1)根据方程式可知,反应前后体积不变,但气体的质量减小。所以若使容器温度升高,平衡时混合气体的平均相对摩尔质量减小,这说明升高温度,平衡向正反应方向移动,即正方应是吸热反应。
(2)维持容器体积和温度不变,达到平衡时C的浓度仍为1.2mol/L,为等效平衡,且为完全等效平衡,按化学计量数转化到左边满足2molA和1molB即可,由2A(g)+B(g) 3C(g)+D(S)可知:
3C(g)+D(S)可知:
①4molA+2molB与初始A、B的物质的量不同,故①错误;
②3molC+lmolD+1molB换算成A、B,A、B物质的量分别为2mol、2mol,与初始A、B的物质的量不同,故②错误;
③3molC+2molD?换算成A、B,A、B物质的量分别为2mol、1mol,D为1mol,D是固体,对平衡无影响,故③正确;
④1.6mol?A+0.8mol?B+0.6molC换算成A、B,没有D,C不能反应,与初始A、B的物质的量不相同,故④错误,答案选③。
(3)若C未转化时,C的物质的量为3mol,此时体积最大,所以容器的体积V=3mol÷1.2mol/L=2.5L;若D完全反应时,平衡时C的物质的量最小,此时体积最小,根据方程式计算反应的C的物质的量:
2A(g)+B(g)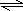 3C(g)+D(S)
3C(g)+D(S)
2.4mol?0.8mol
所以C的物质的量最小为3mol-2.4mol=0.6mol
所以容器的体积V=0.6mol÷1.2mol/L=0.5L
点评:该题是高考中的常见题型,属于中等难度试题的考查,侧重对学生分析、归纳和总结问题的能力,有利于培养学生的逻辑推理能力和发散思维能力。采用极限反应法是解(3)题的关键,采用极限反应法求出C的物质的量,从而求出容器体积范围。
本题难度:困难
5、选择题 已知某可逆反应,x A(g) y B(g),平衡时测得A的浓度为0.5 mol/L,保持温度不变,将容器体积扩大到原来的两倍,再达到平衡时,测得A的浓度为0.3 mol/L。下列判断正确的是
y B(g),平衡时测得A的浓度为0.5 mol/L,保持温度不变,将容器体积扩大到原来的两倍,再达到平衡时,测得A的浓度为0.3 mol/L。下列判断正确的是
A.x < y
B.平衡向正反应方向进行
C.B的体积分数降低
D.缩小体积、增大压强,A的体积分数增大
参考答案:C
本题解析:略
本题难度:一般