|
高考化学知识点总结《有关氧化还原反应的计算》试题巩固(2019年最新版)(十)
2020-08-13 04:53:24
【 大 中 小】
|
1、选择题 高铁酸钾是一种高效绿色水处理剂,其工业制备的反应原理为
2Fe(OH)3 + 3KClO + 4KOH ="=" 2K2FeO4 + 3KCl + 5H2O,下列说法正确的是
A.制备高铁酸钾用ClO-作还原剂
B.制备高铁酸钾时1 mol Fe(OH)3得到3 mol 电子
C.高铁酸钾中铁的化合价为+7
D.用高铁酸钾处理水时,其还原产物能水解产生具有强吸附能力的胶体
|
参考答案:D
本题解析:A项制备高铁酸钾用ClO-作氧化剂,错误;B项制备高铁酸钾时1 mol Fe(OH)3失去3 mol 电子,错误;C项高铁酸钾中铁的化合价为+6,错误;D项用高铁酸钾处理水时,其还原产物(Fe3+)能水解产生具有强吸附能力的氢氧化铁胶体,正确。
考点:考查氧化还原反应原理。
本题难度:一般
2、填空题 (14分)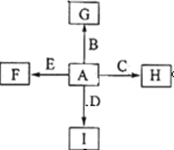
如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知:
① 反应C+G B+H能放出大量的热,G是红综色固体粉末; B+H能放出大量的热,G是红综色固体粉末;
②I是一种常见的温室气体,它和E可以发生反应:2E+I 2F+D,F中的E元素的质量分数为60%. 2F+D,F中的E元素的质量分数为60%.
回答问题:
(1)①中反应的化学方程式为____________________________________
(2) 1.6g G 溶于盐酸,得到的溶液与铜粉完全反应,至少需要铜粉_______克
(3) C与过量NaOH溶液反应的离子方程式为________________________,反应后的溶液与过量的化合物I反应的离子方程式为________________________________
(4) E与I反应的化学方程式为__________________________________
(5) 写出H物质在工业上的一种用途_____________。
(6)将一定量的B完全溶于过量盐酸中,然后通入0.005mol Cl2,再加入0.01mol重铬酸钾晶体(K2Cr2O7),恰好使溶液中B2+全部转化为B3+,铬元素本身被还原为+3价铬离子。通过计算确定原B的物质的量为( )
A.0.01mol B.0.03mol C.0.04mol D.0.07mol
参考答案:⑴2Al+Fe2O3 2Fe+Al2O3 ⑵0.64 2Fe+Al2O3 ⑵0.64
⑶2Al+2OH- + 2H2O==2AlO2-+3H2↑;AlO2-+CO2+2H2O = Al(OH)3↓+HCO3-
⑷2Mg+CO2 2MgO+C ;(5) 耐火材料 炼铝 ; (6)D 。 2MgO+C ;(5) 耐火材料 炼铝 ; (6)D 。
本题解析:根据题意及物质之间的转化关系可知:A是O2;B是Fe;C是Al;D是C;E是Mg;F是MgO;G是Fe2O3;H是Al2O3;I是CO2;(1) ①中是Al与Fe2O3发生的铝热反应,反应的化学方程式为2Al+Fe2O3 2Fe+Al2O3;(2) G是Fe2O3,1.6g G 的物质的量是1.6g÷160g/mol=0.01mol,溶于盐酸,得到FeCl3溶液与铜粉反应,2FeCl3+Cu= 2FeCl2+ CuCl2,根据Fe守恒可得:n(FeCl3)=0.02mol,则根据方程式可知:其完全反应需要消耗Cu的物质的量是0.01mol,其质量是0.01mol×64g/mol=0.64g。(3) Al与过量NaOH溶液反应的离子方程式为2Al+2OH- + 2H2O==2AlO2-+3H2↑;反应后的溶液是NaAlO2,与过量的化合物I反应的离子方程式为AlO2-+CO2+2H2O = Al(OH)3↓+HCO3-;(5) Al2O3是离子化合物,熔沸点高,可以作耐火材料,也可以用于电解冶炼铝。(6)将一定量的Fe完全溶于过量盐酸中得到FeCl2溶液,然后通入0.005mol Cl2,再加入0.01mol重铬酸钾晶体(K2Cr2O7),恰好使溶液中B2+全部转化为B3+,铬元素本身被还原为+3价铬离子。在氧化还原反应中电子得失数目相等,所以n(Fe2+)×1=n(Cl2)×2+n(K2Cr2O7)×2×3. n(Fe2+)=0.005mol×2+0.01mol×2×3=0.07mol.根据Fe守恒可知n(Fe)= n(Fe2+)=0.07mol,故选项是D。 2Fe+Al2O3;(2) G是Fe2O3,1.6g G 的物质的量是1.6g÷160g/mol=0.01mol,溶于盐酸,得到FeCl3溶液与铜粉反应,2FeCl3+Cu= 2FeCl2+ CuCl2,根据Fe守恒可得:n(FeCl3)=0.02mol,则根据方程式可知:其完全反应需要消耗Cu的物质的量是0.01mol,其质量是0.01mol×64g/mol=0.64g。(3) Al与过量NaOH溶液反应的离子方程式为2Al+2OH- + 2H2O==2AlO2-+3H2↑;反应后的溶液是NaAlO2,与过量的化合物I反应的离子方程式为AlO2-+CO2+2H2O = Al(OH)3↓+HCO3-;(5) Al2O3是离子化合物,熔沸点高,可以作耐火材料,也可以用于电解冶炼铝。(6)将一定量的Fe完全溶于过量盐酸中得到FeCl2溶液,然后通入0.005mol Cl2,再加入0.01mol重铬酸钾晶体(K2Cr2O7),恰好使溶液中B2+全部转化为B3+,铬元素本身被还原为+3价铬离子。在氧化还原反应中电子得失数目相等,所以n(Fe2+)×1=n(Cl2)×2+n(K2Cr2O7)×2×3. n(Fe2+)=0.005mol×2+0.01mol×2×3=0.07mol.根据Fe守恒可知n(Fe)= n(Fe2+)=0.07mol,故选项是D。
考点:考查元素及化合物的知识,只有包括物质的推断、性质、用途、化学方程式的书写、守恒法的应用。
本题难度:一般
3、选择题 有关化学用语正确的是
①羟基的电子式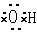 ?②乙烯的结构简式:CH2CH2 ?②乙烯的结构简式:CH2CH2
③硫化氢的电子式 H+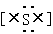 2-H+?④丙烷分子的球棍模型: 2-H+?④丙烷分子的球棍模型: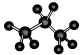
⑤苯分子的比例模型 ?⑥甲烷的结构式 ?⑥甲烷的结构式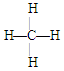
A.①④
B.②③④
C.④⑤⑥
D.②③⑤
参考答案:C
本题解析:①羟基的电子式,错误,氧原子应有一个单电子
②乙烯的结构简式,错误,碳碳双建不能省
③硫化氢的电子式,错误,硫化氢是共价化合物,不是离子化合物,没有阴阳离子
④丙烷分子的球棍模型,⑤苯分子的比例模型,⑥甲烷的结构式都正确,故选C
本题难度:一般
4、选择题 下列反应或过程一定不是氧化还原反应的是(?)?
A.ΔH<0 的反应
B.古人用热分解法制水银
C.用明矾净水
D.实验室用浓盐酸和MnO2制Cl2
参考答案:C
本题解析:氧化还原反应可以是放热反应;单质银可用热分解氧化银来制备,属于氧化还原反应;明矾净水用的是铝离子水解反应生成的氢氧化铝吸附作用净水,因此C中没有氧化还原反应发生;D中用浓盐酸制备氯气是氧化还原反应,故选C。
本题难度:一般
5、选择题 下列有关化学用语,表达正确的是?
A.乙醇的分子式:CH3CH2OH
B.苯分子的比例模型:
C.乙炔的电子式: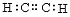
D.溴苯的结构式:C6H5Br
参考答案:B
本题解析:A 错误,这是乙醇的结构简式
B 正确,是比例模型
C 错误,碳的最外层电子没画完。
D 错误,这是溴苯的分子式,结构简式应有苯环。
本题难度:一般
|