1、选择题 下列说法正确的是( )
A.由于钾盐都易溶于水,所以在离子方程式中不可能出现K+
B.酸碱中和反应的离子方程式都可以写为:H++OH-=H2O
C.离子方程式两边的元素种类、原子个数、电荷数都相等时,则该离子方程式一定正确
D.溶液中进行的反应FeCl3+3KSCN?Fe(SCN)3+3KCl达到平衡时,加入KCl晶体,则平衡不移动
参考答案:A.钾的单质及氧化物在离子反应中应保留化学式,如2K+2H2O=2K++2OH-+H2↑,故A错误;
B.如Ba(OH)2与H2SO4反应的离子反应为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故B错误;
C.如Na2S水解若写成S2-+2H2O=H2S↑+2OH-,元素种类、原子个数、电荷数都相等,但水解的实质应先生成HS-,且是可逆反应,故C错误;
D.反应的实质为:Fe3++3SCN-?Fe(SCN)3,可知加入KCl晶体对平衡无影响,故D正确;
故选D.
本题解析:
本题难度:一般
2、简答题 在饱和碳酸钠溶液中通入足量的CO2,溶液中有浑浊出现,写出该反应的离子方程式______,有上述现象发生的原因除了在相同温度下,NaHCO3溶解度小于Na2CO3以外,另外两个原因是______、______.如果要证明最终形成的固体中还含有Na2CO3,所加入的试剂是______,反应的离子方程式为______.
参考答案:碳酸钠与CO2和水反应生成酸式盐NaHCO3,NaHCO3溶解度小于Na2CO3,并且反应生成的NaHCO3固体质量比原来Na2CO3多,溶剂质量减少,溶液中有浑浊出现,反应的离子方程式为2Na++CO32-+H2O+CO2=2NaHCO3↓,Na2CO3与BaCl2或CaCl2反应生成BaCO3或CaCO3沉淀,所以证明最终形成的固体中还含有Na2CO3,可加入BaCl2或CaCl2.
故答案为:2Na++CO32-+H2O+CO2=2NaHCO3↓;反应生成的NaHCO3固体质量比原来Na2CO3多;?溶剂质量减少;BaCl2;Ba2++CO32-=BaCO3↓(或者CaCl2亦可).
本题解析:
本题难度:一般
3、填空题 (1)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式_______________。
(2)在以上中性溶液中,继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式_______________。
参考答案:(1)2H+ +SO42- + Ba2+ +2OH-== BaSO4↓ +2H2O
(2) Ba2+ + SO42- == BaSO4 ↓
本题解析:
本题难度:一般
4、选择题 下列离子方程式中,正确的是
[? ]
A.铁与FeCl3溶液反应 Fe + Fe3+ == 2Fe2+
B.碳酸钙溶于稀盐酸中:CaCO3+2H+=Ca2++H2O+CO2↑
C.铜与稀硝酸反应:Cu+4H++2NO3-==Cu2++2NO↑+2H2O
D.硅酸钠溶液中通入足量二氧化碳:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-
参考答案:BD
本题解析:
本题难度:一般
5、选择题 下列离子方程式不正确的是( )
A.石英与烧碱溶液反应:SiO2+2OH-===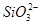 +H2O
+H2O
B.硅与烧碱溶液反应:Si+2OH-+H2O===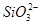 +2H2↑
+2H2↑
C.向小苏打溶液中加入过量的石灰水:2HCO+Ca2++2OH-===CaCO3↓+2H2O+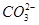
D.往水玻璃中加入盐酸:2H++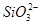 ===H2SiO3↓
===H2SiO3↓
参考答案:C
本题解析:选项C中的离子方程式应该表示的是向小苏打溶液中加入少量的石灰水。因此C错误。
点评:离子方程式的考查,是历年高考的重点,书写离子方程式时,应特别注意量的多少对反应的影响,本题属于易错题。
本题难度:简单