|
高中化学知识点讲解《与量有关的离子方程式的书写》考点强化练习(2019年押题版)(十)
2020-08-13 05:00:37
【 大 中 小】
|
1、选择题 下列关于溶液中离子的说法正确的是
A.0.1 mol/L的Na2CO3溶液中离子浓度关系为
c(Na+) = c(HCO3-) + 2c(CO32-) + c(H2CO3)
B.1 L 1 mol·L-1的CH3COOH溶液中,CH3COO-数目为NA
C.金属钠与水反应的离子方程式为 Na + H2O
D.向碳酸氢钠溶液中加入少量氢氧化钙,其反应的离子方程式为
| 2HCO3— + Ca2+?+ 2OH—??CaCO3↓+ CO32— + 2H2O
参考答案:D
本题解析:略
本题难度:一般
2、简答题 按要求完成以下离子方程式:
(1)碳酸氢钠溶液与盐酸反应______
(2)氯化铁与铜反应______
(3)加热氯化铵与氢氧化钠溶液______.
参考答案:(1)碳酸氢钠溶液与盐酸反应生成了二氧化碳、水、氯化钠,反应的离子方程式为:HCO3-+H+═H2O+CO2↑,
故答案为:HCO3-+H+═H2O+CO2↑;
(2)氯化铁与铜反应生成氯化亚铁和氯化铜,反应的离子方程式为:2Fe3++Cu═2Fe2++Cu2+,
故答案为:2Fe3++Cu═2Fe2++Cu2+;
(3)氯化铵在加热条件下与氢氧化钠溶液反应放出氨气,反应的离子方程式为:NH4++OH-△.NH3↑+H2O,
故答案为:NH4++OH-△.NH3↑+H2O.
本题解析:
本题难度:简单
3、选择题 下列离子方程式,书写正确的是
A.盐酸与碳酸钡反应 CO32-+2H+==CO2↑+H2O
B.硫酸铜溶液中滴加氢氧化钡溶液 Ba2++2OH-+Cu2++SO42-==BaSO4↓+Cu(OH)2↓
C.硝酸银溶液中加入铜粉 Ag++Cu==Cu2++Ag↓
D.铁与稀盐酸反应 2Fe+6H+==2Fe3++3H2↑
参考答案:B
本题解析:A不正确,碳酸钡是难溶性物质,用化学式表示:BaCO3+2H+==CO2↑+H2O+Ba2+。C中电子得失不守恒, 2Ag++Cu==Cu2++2Ag,D中应该生成亚铁离子,Fe+2H+=Fe2++H2↑,答案选B。
本题难度:简单
4、选择题 下列离子方程式正确的是
A.鸡蛋壳浸泡在盐酸中产生气泡:CO32—+2H+===CO2↑+H2O
B.小苏打与氢氧化钠溶液混合:HCO3-+OH-=CO2↑+H2O
C.碘化亚铁溶液中通入少量Cl2:Cl2+2I-===2Cl-+I2
D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4? + 6H+ + 5H2O2= 2Mn2+ + 5O2↑ + 8H2O
参考答案:C
本题解析:蛋壳的主要成分是碳酸钙,而碳酸钙难溶于水,应该用化学式表示,A不正确;碳酸氢钠和氢氧化钠反应碳酸钠和水,B不正确;碘离子的还原性强于亚铁离子,氯气不足时,只氧化碘离子,C正确;高锰酸钾溶液能氧化浓盐酸,D不正确,应该用稀硫酸酸化,答案选C。
点评:判断离子方程式正确与否的方法一般是:(1)检查反应能否发生。(2)检查反应物、生成物是否正确。(3)检查各物质拆分是否正确。(4)检查是否符合守恒关系(如:质量守恒和电荷守恒等)。(5)检查是否符合原化学方程式。
本题难度:一般
5、简答题 (14分)已知:A为含金属离子的淡黄色固体化台物,E、X为空气中常见气体,A、B、C、D含有相同的金属离子,其转化关系如下图(部分产物已略去)。
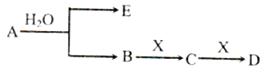
请回答下列问题
(1)这种金属离子的离子结构示意图为_____________;
(2)X的电子式_______________;
(3)B中所含化学键的类型是_____________;
常温常压下,7.8gA与足量的水充分反应放出热量a kJ,写出该反应的热化学方程式
_________________________________________________________________.
(4)①C也可转化为B,写出该转化的化学方程式_______________________________;
②B与D反应的离子方程式为_______________________________________.
(5)将一定量的气体X通入2LB的溶液中,向所得溶液中边逐滴加入稀盐酸边振荡至过量,?产生的气体与盐酸物质的量的关系如图(忽略气体的溶解和HCl的挥发)。
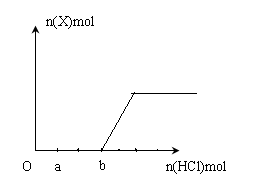
请回答:a点溶液中所含溶质的化学式为__________ ,b点溶液中各离子浓度由大到小的关系是_________________________________。
参考答案:(14分)
(1)Na+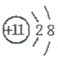 (1分) (1分)
(2)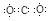 (2分) (2分)
(3)(极性)共价键、离子键(2分)2Na2O2(s)+2H2O(l)=4NaOH(aq)+ O2(g)↑△H=-20akJ/mol(2分)
(4)①Ca(OH)2+Na2CO3=CaCO3↓+2NaOH或 Ba(OH)2+Na2CO3=BaCO3↓+2NaOH
(2分)
②OH-+HCO3-=CO32-+ H2O(2分)
(5)Na2CO3、NaCl (2分)
c(Na+)>c(Cl-)>c(HCO3-)> c(OH-)> c(H+)> c(OH-)> c(CO32-)( c(CO32-)可写可不写,不作评分依据)(2分)
本题解析:(1)A为含金属离子的淡黄色固体化合物,则A为Na2O2,金属离子是Na+,离子结构示意图为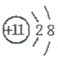 ; ;
(2)A、B、C、D含有相同的金属离子,则B为NaOH,C为Na2CO3,D为NaHCO3,X为CO2,其电子式为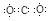 ; ;
(3)NaOH中含有离子键和共价键;
(4)①Na2CO3转化为NaOH,发生复分解反应,需要试剂氢氧化钙或氢氧化钡,化学方程式为Ca(OH)2+Na2CO3=CaCO3↓+2NaOH或Ba(OH)2+Na2CO3=BaCO3↓+2NaOH;
②NaOH与NaHCO3反应生成碳酸钠和水,离子方程式为OH-+HCO3-=CO32-+ H2O;
(5)由图可知产生二氧化碳气体用2体积盐酸,产生二氧化碳之前用3体积盐酸,而Na2CO3~NaHCO3需要的盐酸与NaHCO3~CO2需要的盐酸的量相同,说明滴加盐酸前的溶液中的溶质为Na2CO3、NaOH,且物质的量之比为2:1,所以a点之前发生的反应是盐酸与氢氧化钠的中和反应,a点的溶质为Na2CO3、NaCl;b点时Na2CO3全部转化为NaHCO3,此时溶质为NaHCO3、NaCl,且物质的量之比为2:3,所以溶液中的离子浓度大小关系为c(Na+)>c(Cl-)>c(HCO3-)> c(OH-)> c(H+)> c(OH-)> c(CO32-)。
本题难度:一般
|