1、选择题 一定质量的无水乙醇完全燃烧时放出的热量为Q,它所生成的CO2用过量饱和石灰水完全吸收,可得100g
CaCO3沉淀,则完全燃烧1mol无水乙醇时放出的热量是
[? ]
A.0.5Q
B.Q
C.2Q
D.5Q
参考答案:C
本题解析:
本题难度:一般
2、选择题 化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷(P4)和P4O6的分子结构如下图所示;现提供以下化学键的键能:P-P 198KJ·mol-1.
P-O 360kJ·mol-1.氧气分子内氧原子间的键能为498kJ·mol-1则P4+3O2==P4O6的反应热△H为
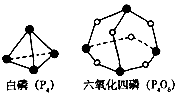
[? ]
A.+1638 kJ·mol-1
B.-1638 kJ·mol-1
C.-126 kJ·mol-1
D.+126 kJ·mol-1
参考答案:B
本题解析:
本题难度:一般
3、选择题
已知使36g焦炭发生不完全燃烧,所得气体中CO占1/3体积,CO2占2/3体积,已知:
C(s)+1/2O2(g)= CO(g) △H =-Q1kJ/mol
CO(g)+1/2O2(g)= CO2(g)△H =-Q2kJ/mol
与这些焦炭完全燃烧相比较,损失的热量是中正确的是
[? ]
A.1/2Q2 kJ
B.Q2 kJ
C.1/3(Q1+Q2)kJ
D.1/3Q1 kJ
参考答案:B
本题解析:
本题难度:一般
4、填空题 (1)已知:Zn(s)+S(斜方)=ZnS(s) △H1= -206. 0kJ/mol;ZnS(s)+2O2(g)=ZnSO4 (s) △H2= -776. 8kJ/mol。试求由单质反应生成ZnSO4(s)的反应热,即 Zn(s)+S(斜方)+2O2(g)=ZnSO4 (s)的△H_______________。
(2)已知热化学方程式:Fe2O3(g)+3CO(g)=2Fe(s)+3CO2(g) △H= -25kJ/mol;
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H= -47kJ/mol;
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H= +19kJ/mol。
写出FeO(s)被CO还原成Fe和CO2的热化学方程式____。
参考答案:(1)由单质生成ZnSO4(s)的反应热△H= -982. 8kJ/mol。
(2) FeO(s)+CO(g)=Fe(s)+CO2(g) △H= -11kJ/mol
本题解析:
本题难度:一般
5、选择题 在20℃时某化学反应的速率为0.15?mol·L-1·s-1,若温度每升高5℃,反应速率提高到原来的2倍,则为使反应速率达到1.2?mol·L-1˙s-1,应使反应在什么温度下进行
A.30℃
B.35℃
C.40℃
D.45℃
参考答案:B
本题解析:0.15 mol·L-1·s-1×2n="1.2" mol˙L-1·s-1,得:n=3,即温度从20℃开始升高了三个5℃,故选B;
本题难度:简单