1、选择题 在298K、1.01×105Pa下,将22g CO2缓慢通入750mL 1mol·L-1 NaOH溶液中充分反应后,测得反应放热为x kJ。已知该条件下,1mol CO2缓慢通入1L 2mol·L-1 NaOH溶液中充分反应后放热为y kJ。则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是
[? ]
A.CO2(g)+NaOH(aq)=NaHCO3(aq) △H=-(2y-x)kJ·mol-1
B.CO2(g)+NaOH(aq)=NaHCO3(aq) △H=-(2x-y)kJ·mol-1
C.CO2(g)+NaOH(aq)=NaHCO3(aq) △H=-(4x-y)kJ·mol-1
D.2CO2(g)+2NaOH(aq)=2NaHCO3(aq) △H=-(8x-y)kJ·mol-1
2、计算题 1.5g火箭燃料二甲基肼(CH3)2N2H2完全燃烧时放热50kJ。求充分燃烧0.5mol二甲基肼放出多少千焦热量?
3、选择题 在某一容积为2L的密闭容器内,加入0.2 mol CO和0.2 mol H2O,在催化剂存在的条件下高温加热,发生如下反应:CO(g) +H2O(g)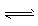 CO2(g) +H2(g) △H=a kJ/mol(a>0)。反应达到平衡后,测得c(CO):c(CO2) =3:2。下列说法中不正确的是
CO2(g) +H2(g) △H=a kJ/mol(a>0)。反应达到平衡后,测得c(CO):c(CO2) =3:2。下列说法中不正确的是
[? ]
A.反应吸收的热量小于0. 2a kJ
B.平衡时H2O的转化率为40%
C.若升高温度,v(正)加快,v(逆)加快,平衡正向移动
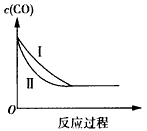
D.如下图中曲线I与Ⅱ分别表示其他条件相同时,在1L与2L的密闭容器内 反应过程中CO的物质的量浓度的变化
4、选择题 相同状况下:H2(g)+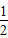 O2(g)=H2O(g);△H=-Q1?kJ/mol;2H2(g)+O2(g)=2H2O(l);△H=-Q2?kJ/mol
O2(g)=H2O(g);△H=-Q1?kJ/mol;2H2(g)+O2(g)=2H2O(l);△H=-Q2?kJ/mol
则Q1和Q2的关系为( )
A.Q1>Q2
B.Q1=Q2
C.2Q1<Q2
D.Q1=1/2Q2
5、计算题 已知:
2H2(g)+O2(g)==2H2O(l); △H =-571.6kJ/mol
2H2(g)+O2(g)==2H2O(g); △H =-483.6kJ/mol
CH4(g)+2O2(g)==2H2O(l)+CO2(g); △H =-890kJ/mol
标准状况下,取甲烷和氢气的混合气体11.2L完全燃烧后恢复到常温,则放出的热量为203.32kJ,试求混合气体中甲烷和氢气体积比__________________。