1、选择题 向甲、乙两个容积均为1 L的恒容容器中,分别充入2 mol A,4 mol B和1 mol A,2 mol B。相同条件下,发生下列反应:A(g)+2B(g) xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示,下列说法正确的是? ( )
xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示,下列说法正确的是? ( )

A.x可能等于3
B.向平衡后的乙容器中充入氦气可使A的转化率降低
C.将乙容器单独升温,c(A)可达到0.78 mol/L
D.若向甲容器中再充入2 mol A,4 mol B,平衡时甲容器中c(A)大于1.56 mol/L
2、填空题 (14分)
含硫化合物在工业生产中有广泛的用途。
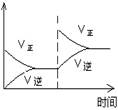
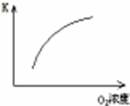
(1)对于可逆反应2SO2(g)+O2(g)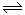 2SO3(g) △H<0,下列研究目的和图示相符的是?
2SO3(g) △H<0,下列研究目的和图示相符的是?
(填序号)
序号
| A
| B
| C
| D
|
目的
| 压强对平衡的影响
| 温度对转化率的影响
| 增加O2浓度对速率的影响
| 浓度对平衡常数的影响
|
图示
| 
| 
| 
| 
|
(2)在5000C有催化剂存在的条件下,向容积为2L的甲乙两个密闭容器中均充入2molSO2和1molO2。甲保持容积不变,乙保持压强不变,充分反应后,均达平衡状态,此时SO3的体积分数甲
?乙。(填“>”“<”或“="”" )
(3)向2L的甲容器中充入2molSO2、1molO2,测得SO2的平衡转化率与温度的关系如下图所示。
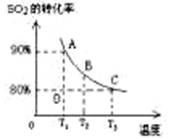
Ⅰ.在T1温度下,反应进行到状态D时,v正?v逆。(填“>”“<”或“="”" )
Ⅱ.T3温度下,平衡时测得反应放出的热量为Q1,在相同温度下若再向容器中通入2molSO2、1molO2,重新达到平衡,测得反应又放出热量Q2 。则下列说法中正确的是?。(填序号)
A.相同温度下新平衡时容器中的压强是原平衡时的两倍
B.Q2一定大于Q1
C.新平衡时SO2的转化率一定大于80%
(4)在甲容器中充入一定量的SO2和1.100molO2,在催化剂作用下加热,当气体的物质的量减少0.315mol时反应达到平衡,此时测得气体压强为反应前的82.5%,则SO2的转化率为?。
(5)若用氢氧化钠溶液吸收SO2气体恰好得到酸式盐,已知该酸式盐溶液呈弱酸性,则溶液中各离子浓度由大到小的顺序为?。(用离子浓度符号表示)
(6)一定温度下,用水吸收SO2气体,若得到pH=5的H2SO3溶液,则溶液中亚硫酸氢根离子和亚硫酸根离子的物质的量浓度之比为? ?。(已知该温度下H2SO3的电离常数:Ka1=1.0×10-2mol/L,Ka2=6.0×10-3mol/L)
3、选择题 在密闭容器中进行反应X2(g)+3Y2(g)  ?2Z2(g),若X2、Y2、Z2的起始浓度分别为0.1 mol/L、0.3 mol/L、0.2 mol/L,达到平衡时下列物质的浓度可能为(? )
?2Z2(g),若X2、Y2、Z2的起始浓度分别为0.1 mol/L、0.3 mol/L、0.2 mol/L,达到平衡时下列物质的浓度可能为(? )
A. X2为0.2 mol/L
B. Y2为0.2 mol/L
C. Z2为0.4 mol/L
D. Y2为0.6 mol/L
4、填空题 (5分)可逆反应3A(g) 3B(?)+C(?)? △H>0达到化学平衡后,
3B(?)+C(?)? △H>0达到化学平衡后,
(1)升高温度,用“变大”、“变小”、“不变”或“无法确定”填空。
a.若B、C都是气体,气体的平均相对分子质量①?;
b.若B、C都不是气体,气体的平均相对分子质量?② ;
c.若B是气体,C不是气体,气体的平均相对分子质量③ ;
(2)如果平衡后保持温度不变,将容器体积增加一倍,新平衡时A的浓度是原来的60%,则B是④?态,C是⑤?态。
5、填空题 工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为:CrO42-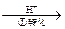 Cr2O72-
Cr2O72- Cr3+
Cr3+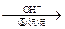 Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:2CrO42-(黄色)+2H+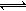 Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
⑴若平衡体系的pH=2,该溶液显?色。
⑵能说明第①步反应达平衡状态的是? ?。
?。
a. Cr2O72-和CrO42-的浓度相同? b.2v(Cr2O72-)=v(CrO42-)? c.溶液的颜色不变
⑶第②步中,还原1molCr2O72-离子,需要?mol的FeSO4 7H2O。
7H2O。
方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
⑷用Fe做电极的原因为?。
⑸在阴极附近溶液pH升高的原因是(用电极反应解释)?,溶液中同时生成的沉淀还有?。
⑹写出Cr2O72--变为Cr3+的离子方程式___________________;