1、选择题 在恒温条件下,一定体积的容器中放入3L气体R和2L气体Q,在一定条件下发生反应:4R(g)+3Q(g) 
 ?2X(g) +nY(g),反应达平衡后,容器内温度不变,混合气体的压强比原来减小了,则反应中方程式的n值是
?2X(g) +nY(g),反应达平衡后,容器内温度不变,混合气体的压强比原来减小了,则反应中方程式的n值是
A.4
B.5
C.6
D.7
参考答案:A
本题解析:由于反应达平衡后,容器内温度不变,混合气体的压强比原来减小了,即该反应的正反应方向为气体体积减少的方向,即n值必小于5,所以正确选项为A;
本题难度:一般
2、选择题 已知N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.在一恒温恒压的密闭容器里充入2mol?N2和8mol?H2达到平衡时生成1mol?NH3.现在相同条件下的同一容器中充入xmol?N2,ymol?H2和2mol?NH3,达到平衡时,NH3的质量分数与原来相同,且放出热量46.2kJ.则x、y的值为( )
A.1.5,6.5
B.2,8
C.5,21
D.3,13
参考答案:N2(g)+3H2(g)?2NH3(g)
开始2? 8? 0
转化0.5?1.5? 1
平衡1.5? ?6.5?1
氮气的转化率为0.5mol2mol×100%=25%,放出热量为46.2kJ;
相同条件下的同一容器中充入xmol?N2,ymol?H2和2mol?NH3,达到平衡时,NH3的质量分数与原来相同,且放出热量46.2kJ,
则二者为等效平衡,所以
? ?N2(g)+3H2(g)?2NH3(g)
开始x?y? 2
等效x+1? y+3
则x+1y+3=2mol8mol=14,
解得4x+1=y,
A.4×1.5+1≠6.5,故A错误;
B.4×2+1≠8,故B错误;
C.5×4+1=21,由放出的热量设氮气转化nmol,则92.4n-92.4=46.2,所以n=1.5mol,氮气的转化率为25%,故C正确;
D.3×4+1=13,由放出的热量设氮气转化nmol,则92.4n-92.4=46.2,所以n=1.5mol,氮气的转化率为37.5%,故D错误;
故选C.
本题解析:
本题难度:一般
3、计算题 (13分)在25℃时,将等物质的量的A、B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g) 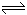 xC(g)+2D(g) ;△H>0,经5min后测知D的浓度为0.5mol/L,
xC(g)+2D(g) ;△H>0,经5min后测知D的浓度为0.5mol/L,
A、B的物质的量浓度之比为3:5,C的平均反应速率是0.1mol/(L·min),求:
(1)此时A的物质的量浓度是?;
反应开始前容器中的A、B的物质的量:n(A)= n(B)=??
(2)x的值为?;5min内B的平均反应速率?;
(3)下列措施能使正反应速率增大的是?(不定项选择)
A. 只增大A的浓度? B.增大反应的温度
C. 向容器中通入一定体积的He,增大反应的压强? D. 使用催化剂
(4)若改用3L的密闭容器,盛放与上述相同量的A、B气体,则达到平衡后,A和B的物质的量浓度的比值?3:5(填“>”“=”“<”)。
参考答案:(13分)(1)0.75mol/L? 3mol?(2)0.05mol/(L·min)? 2
(3) ABD?(4)=
本题解析:考查可逆反应的有关计算及外界条件对反应速率和平衡的影响。
(1)C的平均反应速率是0.1mol/(L·min),则C的浓度是0.5mol/L,所以根据变化量之比是相应的化学计量数之比可知x=2。又因为反应速率之比是相应的化学计量数之比,所以B的反应速率是0.1mol/(L·min)÷2=0.05mol/(L·min)。
(2)? 3A(g)+B(g) 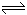 2C(g)+2D(g)
2C(g)+2D(g)
起始量(mol)? n? n? 0? 0
转化量(mol)? 1.5? 0.5? 1.0? 1.0
平衡量(mol)? n-1.5? n-0.5? 1.0? 1.0
所以有(n-1.5)︰(n-0.5)= 3:5
解得n=3mol,所以A的浓度是1.5mol÷2L=0.75mol/L
(3)在其它条件不变的情况下,增大反应物浓度或升高温度或增大压强或使用催化剂等均能加快反应速率,选项C中浓度不变,反应速率不变,所以答案选ABD。
(4)因为反应前后体积不变,所以此时的平衡是等效的,因此比值不变。
本题难度:一般
4、选择题 一定条件下,在体积为10L的密闭容器中,1 mol X和1 mol Y进行反应:
2X(g)+Y(g)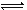 Z(g),经60s达到平衡,生成0.3 mol Z,下列正确的是(? )
Z(g),经60s达到平衡,生成0.3 mol Z,下列正确的是(? )
A.60s里以X浓度变化表示的反应速率为0.001 mol/(L·s)
B.将容器体积变为20 L,Z的平衡浓度变为原来的1/2
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则正反应的DH>0
参考答案:A
本题解析:经60s达到平衡,生成0.3 mol Z,所以用Z表示的反应速率为
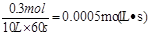 。因为速率之比是相应的化学计量数之比,所以以X浓度变化表示的反应速率为以X浓度变化表示的反应速率为0.0005 mol/(L·s)×2=0.001 mol/(L·s),A正确。增大容器的体积,压强减小,平衡向逆反应方向移动,所以Z的平衡浓度小于原来的1/2,B不正确。增大压强,平衡向正反应方向移动,反应物的转化率增大,C不正确。升高温度,X的体积分数增大,说明平衡向逆反应方向移动,所以正反应是放热反应,D不正确。答案选A。
。因为速率之比是相应的化学计量数之比,所以以X浓度变化表示的反应速率为以X浓度变化表示的反应速率为0.0005 mol/(L·s)×2=0.001 mol/(L·s),A正确。增大容器的体积,压强减小,平衡向逆反应方向移动,所以Z的平衡浓度小于原来的1/2,B不正确。增大压强,平衡向正反应方向移动,反应物的转化率增大,C不正确。升高温度,X的体积分数增大,说明平衡向逆反应方向移动,所以正反应是放热反应,D不正确。答案选A。
本题难度:简单
5、填空题 气候变暖冰川融化将会对人类产生极大的灾害。如南极冰盖全部融化,南太平洋上的美丽岛国图瓦卢很可能成为首个“沉没”的国家,喜马拉雅山冰川融化尼泊尔会有“灭顶”之灾,近海城市遭受城市淹没、海啸等灾害。所以合理利用资源,加强环境保护。降低碳的排放,实施低碳经济是今后经济生活主流。
(1)下列措施对有效减少二氧化碳排放和降低大气中二氧化碳不适合的是___________________
A.使用天然气等燃料
B.植树造林,保护森林,保护植被
C.大力发展风能、水力、潮汐能发电和核电,大力推行太阳能的综合开发
D.立即减少煤和石油化石燃料的使用
E.建筑物中尽量利用自然通风采光,推广使用节能灯和节能电器,使用空调时夏季温度不宜设置过低,冬天不宜过高
F.全民倡导出行时多步行和骑自行车;建设现代物流信息系统,减少运输工具空驶率
(2)目前用超临界CO2(其状态介于气态和液态之间)代替氟利昂作致冷剂已成为一种趋势,这一做法对环境的积极意义在于保护______________________。
(3)科学家致力于二氧化碳的“组合转化”技术研究,把过多的二氧化碳转化为有益于人类的物质。如将CO2和H2以1∶4比例混合通入反应器,在适当条件下反应可获得一种重要能源。请完成以下化学方程式:CO2+4H2==___________+2H2O
(4)收集提纯炼铁、炼钢等工厂所排放的气体,可得高纯度的CO,在适当的条件下,用CO和H2反应可获得人工合成汽油,也可减少碳的排放,节约能源。假设此人工合成汽油是碳原子数为5~8的烷烃,要达到合成汽油的要求,通入反应装置里的CO和H2的物质的量之比范围是______≤n(CO)/n(H2) ≤______(保留最简分数比形式)
(5)探究CO2来生产燃料甲醇(CH3OH)的反应原理,现进行如下实验在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)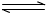 CH3OH(g)+H2O(g)测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g)测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
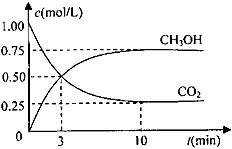
从反应开始到平衡,氢气的平均反应速率v(H2)=_________________。
参考答案:(1)AD
(2)臭氧层
(3)CH4
(4)5/11;8/17
(5)0.225 mol/(L·min)
本题解析:
本题难度:一般