1、填空题 已知H+(aq)+OH-(aq) H2O(l) ΔH="-57.3" kJ·mol-1,回答下列问题。
H2O(l) ΔH="-57.3" kJ·mol-1,回答下列问题。
(1)用含20 g NaOH的稀溶液跟足量稀盐酸反应放出 kJ的热量。?
(2)用含2 mol H2SO4的稀溶液跟足量稀NaOH反应,此反应的中和热为 。?
(3)如果将(1)反应中的稀盐酸换成稀醋酸,反应放出的热量 (填“大于”“小于”或“等于”)原来(1)放出的热量。?
参考答案:(1)28.65 (2)57.3 kJ·mol-1 (3)小于
本题解析:(1)="0.5" mol,所以0.5 mol NaOH与足量稀盐酸反应放出的热量为0.5 mol×57.3 kJ·mol-1="28.65" kJ。
(2)据中和热的定义可知,中和热与强酸、强碱的物质的量的多少无关,中和热为57.3 kJ·mol-1。
(3)因醋酸为弱酸,用NaOH中和时,需不断地电离出H+,而电离过程要吸收热量,故反应放出的热量会减小。
本题难度:一般
2、选择题 在298 K、1.01×105 Pa下,将22 g CO2通入750 mL 1 mol·L-1 NaOH溶液中充分反应,测得反应放出x kJ的热量。已知在该条件下,1 mol CO2通入1 L 2 mol·L-1 NaOH溶液中充分反应放出y kJ的热量。则CO2与NaOH溶液反应生成NaHCO3的热化学方程式为( )。
A.CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(2y-x) kJ·mol-1
B.CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(2x-y) kJ·mol-1
C.CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(4x-y) kJ·mol-1
D.CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(8x-2y) kJ·mol-1
参考答案:C
本题解析:本题考查化学反应与能量变化。
先算出CO2和NaOH的物质的量,分别是0.5mol和0.75mol.由题意知,CO2过量。首先发生CO2 + 2NaOH="Na2CO3+H2O"
0.375---0.75--
放出热量为0.375y
然后
CO2? + H2O+Na2CO3=2NaHCO3,设反应热为Z
0.125--------
则放出热量为0.125Z
两式相加,得到
2CO2+2NaOH=2NaHCO3,由题意知
X=0.375y+0.125Z=0.125(y+Z)+0.25y。
设2CO2+2NaOH=2NaHCO3的反应热为2A。
得2A=y+Z
那么CO2+NaOH=NaHCO3的反应热A=4x-y。
所以答案选C。
本题难度:一般
3、选择题 根据碘与氢气反应的热化学方程式:
H2(g)+I2(g)?2HI(g)△H=-26.48kJ?mol-1 ①
H2(g)+I2(s)?2HI(g)△H=+9.48kJ?mol-1?②
下列判断正确的是( )
A.254g?I2(g)中通入2g H2(g),反应放热26.48kJ
B.反应②的反应物总能量比反应①的反应物总能量低
C.反应①是放热反应,说明该反应在常温下很容易发生
D.1mol固态碘与1mol气态碘所含的能量相差17.00kJ
参考答案:A、254g?I2(g)中通入2g H2(g),反应放热小于26.48kJ,故A错误;
B、H2(g)+I2(s)?2HI(g)△H=+9.48kJ?mol-1,反应是吸热反应,反应物总能量比反应①的反应物总能量低,故B正确;
C、反应①是放热反应,但该反应在常温下不一定很容易发生,和反应条件有关,故C错误;
D、H2(g)+I2(g)?2HI(g)△H=-26.48kJ?mol-1 ①;H2(g)+I2(s)?2HI(g)△H=+9.48kJ?mol-1?②;依据盖斯定律①-②得到I2(g)?I2(s)△H=-35.96kJ?mol-1 ;说明1mol固态碘与1mol气态碘所含的能量相差35.96kJ,故D错误;
故选B.
本题解析:
本题难度:简单
4、选择题 已知热化学方程式:2H2(g)+O2(g)=2H2O(g) ΔH1=-483.6kJ/mol,则对于热化学方程式:2H2O(l)=2H2(g)+O2(g) ΔH2=b,下列说法正确的是[ ]
A.该反应的ΔH2=+483.6kJ/mol
B.|ΔH2|<|ΔH1|
C.|ΔH2|>|ΔH1|
D.热化学方程式中化学计量数表示分子个数
参考答案:C
本题解析:A 错误,该反应的ΔH2>+483.6kJ/mol ,如果是气态水分解,ΔH2="+483.6kJ/mol" 但该反应是液态水分解,所以吸收的热量要大于483.6kJ,由此可知,B 选项错误,C选项正确,
D 错误,热化学方程式中化学计量数不仅表示分子个数,也表示物质的量。
本题难度:一般
5、填空题 能源是人类生存和发展的重要支柱。研究和有效地开发新能源在能源紧缺的今天具有重要的理论意义。
(1)已知下列热化学方程式:
① H2(g)+1/2O2(g) =H2O(g)?ΔH=-241.8 kJ/mol?
② C(s)+1/2O2(g) =CO(g)?ΔH=-110.5 kJ/moL?
则水煤气能源的制取原理:C(s)+H2O(g)=H2(g)+CO (g)?ΔH=?kJ/moL
(2)研究活化能对于能源技术的革新有非常重大的实际意义。请认真观察下图,回答问题:
① 图中反应的ΔH=?kJ/mol(用含有E1、E2代数式表示)。
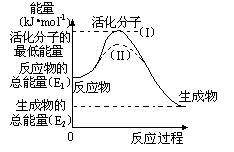
② 已知热化学 方程式:H2(g)+1/2O2(g) =?H2O(g)?ΔH=-
方程式:H2(g)+1/2O2(g) =?H2O(g)?ΔH=- 241.8 kJ/mol,该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为?kJ/mol。
241.8 kJ/mol,该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为?kJ/mol。
③ 图中虚线(II)与实线(I) 对于同一反应具有的意义:
??。
参考答案:(1)+131.3
(2)① —(E1- E2)或(E2-E1)
② 409?
③ 降低反应所需的活化能,增大单位体积内活化分子的百分 数,提高反应
数,提高反应 速率。
速率。
本题解析:略
本题难度:简单