1、选择题 下列说法或表示方法中正确的是
A.等质量的硫蒸气和硫固体分别完全燃烧后都恢复至常温,后者放热量多
B.在101 kPa 时,2 g H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式为:2H2 (g) + O2 (g) = 2H2O (l) ;△H =" +285.8" kJ / mol
C.已知中和热为57.3 kJ·mol-1,若将含0.5mol H2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量大于57.3kJ
D.Ba(OH)2·8H2O (s) + 2NH4Cl (S) = BaCl2 (s) + 2NH3(g) + 10H2O(l);△H<0
参考答案:C
本题解析:略
本题难度:一般
2、选择题 已知
(1)H2( g )+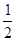 O2?( g ) = H2O ( g )?ΔH1?=" a" kJ/mol
O2?( g ) = H2O ( g )?ΔH1?=" a" kJ/mol
(2)2H2( g )+O2?( g ) =2H2O ( g )?ΔH2?=" b" kJ/mol
(3) H2( g )+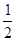 O2?( g ) = H2O ( l )?ΔH3?=" c" kJ/mol
O2?( g ) = H2O ( l )?ΔH3?=" c" kJ/mol
(4) 2H2( g )+O2?( g ) =2H2O ( l )?ΔH4?=" d" kJ/mol
则a、b、c、d的关系正确的是(?)。
A.c<a<0
B.b>d>0
C.2a=b< 0
D.2c=d>0
参考答案:AC
本题解析:氢气燃烧是放热反应,△H小于0。由于参加反应的氢气越多,放热越多,所以2a=b<0,2c=d<0。又因为气态水的能量高于液态水的能量,所以氢气燃烧生产液态水放出的能量多,所以2c=d<2a=b<0,因此正确的答案选AC。
本题难度:一般
3、选择题 工业生产水煤气的反应为:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.4 kJ·mol-1,下列判断正确的是? ( )。
A.反应物能量总和大于生成物能量总和
B.CO(g)+H2(g)=C(s)+H2O(l)ΔH=-131.4 kJ·mol-1
C.水煤气反应中生成1 mol H2(g)吸收131.4 kJ热量
D.水煤气反应中生成1体积CO(g)吸收131.4 kJ热量
参考答案:C
本题解析:该反应为吸热反应,故反应物的总能量小于生成物的总能量,A错;B项的热化学方程式中的水的状态应为液态;D项中1体积应是1 mol。
本题难度:简单
4、选择题 反应C(石墨)?C(金刚石)是吸热反应,由此可知( )
A.石墨比金刚石更稳定
B.金刚石的能量比石墨的低
C.金刚石比石墨稳定
D.金刚石和石墨不能相互转化
参考答案:A、石墨转化为金刚石要吸收能量,说明石墨的能量低,稳定,故A正确;
B、石墨转化为金刚石要吸收能量,说明石墨的能量低,金刚石的能量比石墨的高,故B错误;
C、石墨转化为金刚石要吸收能量,说明石墨的能量低,能量越低越稳定,所以石墨稳定,故C错误;
D、金刚石和石墨是不同的物质,二者可以相互转化,故D错误.
故选:A.
本题解析:
本题难度:简单
5、选择题 下列图中能正确表示X + 3Y = 2Z(放热反应)过程的能量变化的是:
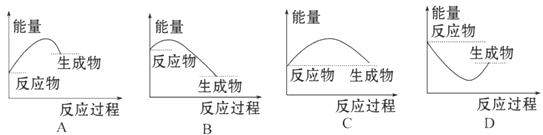
参考答案:B
本题解析:A.由于生成物的能量比反应物高,所以该反应为吸热反应。错误。B.由于反应物的能量比生成物高,所以该反应为放热反应。正确。C。由于反应物、生成物的能量相同,所以反应过程中无能量变化。错误。D.化学反应的过程就是旧键断裂、新键形成的过程。断裂化学键要吸收能量。这与图像画的不符合。错误。
本题难度:简单