1、选择题 下列叙述不正确的是
A.NaCl的摩尔质量是58.5g/mol
B.将wg a%的NaCl溶液蒸发掉 g水,得到2a%的NaCl溶液
g水,得到2a%的NaCl溶液
C.将1体积cmol/L的硫酸用水稀释为5体积,稀溶液的浓度为0.2cmol/L
D.将5.85gNaCl晶体溶入1000mL水中,制得0.1mol/L的NaCl溶液
参考答案:D
本题解析:A 正确
B 正确,溶剂减少一半,质量分数增大一倍
C 正确,根据稀释前后溶质的物质的量浓度不变计算
D 错误,应该是溶于水中配成1000mL溶液。
本题难度:一般
2、选择题 NA代表阿伏加德罗常数,下列说法错误的是
A.标准状况下,22.4 L NO和22.4 L O2的混合,混合气体中含有的氧原子数为3NA
B.0.012 kg 13C中,含中子数为7NA
C.25 ℃时,1 L pH=13的氢氧化钡溶液中含有0.1NA个氢氧根离子
D.在反应3SiO2+6C+2N2  Si3N4+6CO,生成1 mol Si3N4时共转移12 NA电子
Si3N4+6CO,生成1 mol Si3N4时共转移12 NA电子
参考答案:B
本题解析:在22.4 L NO中有1 mol氧原子、22.4 L O2 2 mol氧原子,此处特别注意化学反应不改变原子数,A项正确;0.012 kg 13C不是1 mol, 含中子数小于7NA,B项错误;pH=13,c(H+)=0.1 mol/L,n(H+)=1 L×0.1 mol/L=0.1 mol,C项正确;在反应中6个C失去12个电子,2N2得到12个电子,生成1 mol Si3N4时共转移12 NA电子,D项正确。
本题难度:一般
3、选择题 用NA代表阿伏伽德罗常数。下列说法正确的是
A.1molNH3中含有3NA对电子对
B.工业用电解法进行粗铜精炼时,每转移1mol电子,阳极上溶解的铜原子数必为0.5NA
C.将2 mol SO2和1 molO2混合在V2O5存在条件下的密闭容器中,充分反应后分子总数等于2 NA
D.VLa mol·L-1的氯化铁溶液中,若Fe3+的数目为NA,则Cl-的数目大于3NA
参考答案:B
本题解析:A 错误,1molNH3中含有4NA对电子对
B 错误,每转移1mol电子,阳极上溶解的铜原子数不一定为0.5NA,因为是粗铜,比铜活泼的金属先失去电子。
C 错误,此反应是可逆反应,反应不彻底,得不到2mol SO3
D 正确,Fe3+水解,Cl-的浓度大于三倍的Fe3+浓度。
本题难度:一般
4、填空题 有一质量为mg,相对分子质量为M的某种强碱M (OH)2,在一定温度下,完全溶解在水中得到VmL饱和溶液,若此溶液的密度为ρg/cm3,则该溶液中OH-的物质的量浓度为__________,溶质的质量分数为___________,此温度下该碱的溶解度为_________。
参考答案: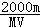 mol/L?
mol/L?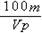 ?%?
?%?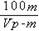 g
g
本题解析:略
本题难度:简单
5、选择题 用 25.30mL 98%的浓H2SO4(d=1.84g/cm3)配制20%的H2SO4溶液(d=1.14 g/cm3)200.00 mL,需加水
A.181.55 mL
B.174.70 mL
C.182 mL
D.200 mL
参考答案:A
本题解析:略
本题难度:简单