| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《物质的分离、提纯》在线测试(2019年最新版)(六)
 参考答案:B 本题解析: 本题难度:一般 3、选择题 如下表提纯下列物质(括号内为杂质),所用的除杂试剂和分离方法都正确的是(? )
分离与提纯的原则和要求: 常见的分离与提纯的方法: (1)物质分离与提纯常用的物理方法 (2)物质分离与提纯常用的化学方法: ①加热法 混合物中混有某些热稳定性差的物质时,可直接加热,使热稳定性差的物质分解而分离出来。例如:食盐中混有氯化铵、纯碱中混有小苏打等均可直接加热除去杂质。 ②沉淀法 在混合物中加入某试剂,使其中一种以沉淀形式分离出去的方法。使用该方法一定要注意不能引入新杂质,若使用多种试剂将溶液中不同粒子逐步沉淀时,应注意后加入试剂能将先加入的过量试剂除去,最后加入的试剂不引入新杂质。例如:加入适量BaCl2溶液可除去NaCl中混有的Na2SO4。 ③转化法 利用化学反应将某种物质进行多次转化而分离。例如:分离Fe3+和Al3+时,可加入过量的NaOH溶液,生成Fe(OH)3和NaAlO2,过滤后,分别再加盐酸重新生成Fe3+和Al3+。注意转化过程中尽量减少被分离物质的损失.而且转化后的物质要易恢复为原物质。 ④酸碱法 被提纯物质不与酸或碱反应,而杂质可与酸或碱发生反应,可用酸或碱作除杂试剂。例如:用盐酸除去 SiO2中的石灰石,用氢氧化钠除去铁粉中的铝粉。 ⑤氧化还原法 a.对混合物中混有的还原性杂质,可加入适当的氧化剂将杂质氧化为被提纯物质。例如:将氯水滴入混有FeCl2的FeCl3溶液中,除去FeCl2杂质。 b.对混合物中混有的氧化性杂质,可加入适当还原剂将杂质还原为被提纯物质。例如:将过量铁粉加入混有FeCl3的FeCl2溶液中,振荡过滤,除去FeCl3 杂质。 ⑥调节pH法 通过加入试剂来调节溶液的pH,使溶液中某组分沉淀而分离的方法。一般加入相应的难溶或微溶物来调节。例如:在CaCl2溶液中含有FeCl3杂质,由于 Fe3+水解,溶液呈酸性,可采用调节溶液pH的方法将 Fe3+沉淀除去,为此,可向溶液中加氧化钙或氢氧化钙或碳酸钙等。 ⑦电解法 此法利用电解原理来分离、提纯物质。例如:电解精炼铜,将粗铜作阳极,精铜作阴极,电解液为含铜离子的溶液,通直流电,在阳极铜及比铜活泼的杂质金属失电子,在阴极只有铜离子得电子析出,从而提纯了铜。考点名称:离子的检验
(1)焰色反应:Na+:黄色;K+:紫色(透过蓝色钴玻璃观察);Ca2+:砖红色; (2)H+:H+酸性。遇紫色石蕊试液变红,遇湿润蓝色石蕊试纸变红; (3)NH4+:在试液中加强碱(NaOH)加热,产生使湿润红色石蕊试纸变蓝的气体;NH4++OH- 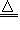 NH3↑+H2O;NH3+H2O NH3↑+H2O;NH3+H2O NH3?H2O NH3?H2O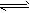 NH4++OH- NH4++OH-(4)Fe3+:①通KSCN或NH4SCN溶液呈血红色:Fe3++SCN-==[Fe(SCN)]2+;②通NaOH溶液红褐色沉淀:Fe3++3OH-== Fe(OH)3↓ (5)Fe2+:①遇NaOH溶液生成白色沉淀在空气中迅速转化成灰绿色最后变成红褐色沉淀:Fe3++2OH-=Fe(OH)2↓; 4Fe(OH)2+O2+2H2O==4Fe(OH)3; ②试液中加KSCN少量无明显变化再加氯水出现血红色: 2Fe2++Cl2==2Fe3++2Cl-;Fe3++SCN-==[Fe(SCN)]2+ (6)Mg2+:遇NaOH溶液有白色沉淀生成,NaOH过量沉淀不溶解:Mg2++2OH-==Mg(OH)2↓,但该沉淀能溶于NH4Cl溶液; (7)Al3+:遇NaOH溶液(适量)有白色沉淀生成,NaOH溶液过量沉淀溶解:Al3++3OH-==Al(OH)3↓;Al(OH)3+OH-== AlO2-+2H2O (8)Cu2+:遇NaOH溶液有蓝色沉淀生成,加强热变黑色沉淀:Cu2++2OH-==Cu(OH)2↓;Cu(OH)2  CuO+H2O CuO+H2O (9)Ba2+:遇稀H2SO4或硫酸盐溶液有白色沉淀生成,加稀HNO3沉淀不溶解:Ba2++SO42-==BaSO4↓ (10)Ag+: ①加NaOH溶液生成白色沉淀,此沉淀迅速转变为棕色沉淀溶于氨水Ag++OH-==AgOH↓;2AgOH==Ag2O+H2O;AgOH+2NH3?H2O==[Ag(NO3)2]OH+2H2O ②加稀HCl或可溶性氧化物溶液再加稀HNO3生成白色沉淀:Ag++Cl-==AgCl↓ (11)OH-:OH-碱性:①遇紫色石蕊试液变蓝;②遇酚酞试液变红;③遇湿润红色石蕊试纸变蓝; (12)Cl-:遇AgNO3溶液有白色沉淀生成,加稀HNO3沉淀不溶解:Ag++Cl-=AgCl↓ (13)Br-:加AgNO3溶液有浅黄色沉淀生成,加稀HNO3沉淀不溶解:Ag++Br-=AgBr↓ (14)I-: ①加AgNO3溶液有黄色沉淀生成,加稀HNO3沉淀不溶解:Ag++I-=AgI↓;②加少量新制氯水后再加淀粉溶液显蓝色:2I-+Cl2=I2+2Cl-;I2遇淀粉变蓝 (15)S2-:①加强酸(非强氧化性)生成无色臭鸡蛋气味气体:S2-+2H+=H2S↑;②遇Pb(NO3)2或(CH3COO)2Pb试液生成黑色沉淀,遇CuSO4试液产生黑色沉淀:Pb2++S2-=PbS↓;Cu2++S2-=CuS↓ (16)SO42-:加可溶性钡盐[BaCl2或Ba(NO3)2]溶液有白色沉淀生成后再加稀HCl或稀HNO3沉淀不溶解:Ba2++SO42-=BaSO4↓ (17)SO32-:加强酸(H2SO4或HCl)把产生气体通入品红溶液中,品红溶液褪色:SO32-+2H+=H2O+SO2↑ SO2使品红溶液褪色 (18)CO32-:加稀HCl产生气体通入澄清石灰水,石灰水变浑浊:CO32-+2H+=H2O+CO2↑;CO2+Ca(OH)2=CaCO3↓+H2O (19)HCO3-:取含HCO3-盐溶液煮沸,放出无色无味、使澄清石灰水变浑浊的气体;或向HCO3-溶液里加入稀MgSO4溶液,无现象,加热煮沸有白色沉淀MgCO3生成,同时放出CO2气体。 (20)NO3-:浓缩试液加稀硫酸和铜片加热有红棕色气体产生,溶液变成蓝色: Cu+4H++2NO3-=Cu2++2NO2↑+2H2O (21)PO43-:加AgNO3溶液产生黄色沉淀,再加稀HNO3沉淀溶解:3Ag++PO43-=Ag3PO4↓;Ag3PO4溶于稀HNO3酸。 考点名称:粗盐的提纯
(1)实验仪器和药品 药品:粗盐,水 器材:托盘天平,量筒,烧杯,玻璃棒,药匙,漏斗,铁架台(带铁圈),蒸发皿,酒精灯,坩埚钳,胶头滴管,滤纸,剪刀,火柴,纸片 (2)实验原理:粗盐中含有泥沙等不溶性杂质,以及可溶性杂质如:Ca2+、Mg2+等不溶性杂质可以用溶解、过滤的方法除去,然后蒸发水分得到较纯净的精盐 (3)实验操作 ①溶解:用托盘天平称取5克粗盐(精确到0.1克)。用量筒量取10毫升水倒入烧杯里.用药匙取一匙粗盐加入水中,观察发生的现象。用玻璃棒搅拌,并观察发生的现象(玻璃棒的搅拌对粗盐的溶解起什么作用?)。接着再加入粗盐,边加边用玻璃棒搅拌,一直加到粗盐不再溶解时为止。观察溶液是否浑浊。 在天平上称量剩下的粗盐,计算在10毫升水中大约溶解了多少克粗盐. ②过滤:按照过滤的操作进行过滤,仔细观察滤纸上的剩余物及滤液的颜色。滤液仍浑浊时,应该再过滤一次。如果经两次过滤滤液仍浑浊,则应检查实验装置并分析原因,例如:滤纸破损,过滤时漏斗里的液面高于滤纸边缘,仪器不干净等,找出原因后,要重新操作。 ③蒸发:把得到的澄清滤液倒入蒸发皿,把蒸发皿放在铁架台的铁圈上,用酒精灯加热,同时用玻璃棒不断搅拌滤液。等到蒸发皿中出现较多量固体时,停止加热。利用蒸发皿的余热使滤液蒸干。 ④用玻璃棒把固体转移到纸上,称量后,回收到教师指定的容器,比较提纯前后食盐的状态并计算精盐的产率。 以上内容为91考试网学习社区(www.91exam.org)原创内容,未经允许不得转载! 发现相似题 与“如下表提纯下列物质(括号内为杂质),所用的除杂试剂和分离方法都..”考查相似的试题有:
参考答案:C 本题解析:略 本题难度:简单 4、填空题 蓝铜矿主要含xCuCO3·yCu(OH)2,还含有少量Fe的化合物,工业上以蓝铜矿为原料制备Cu、CaCO3和CuSO4.5H2O。具体方法步骤如下:
(1)蓝铜矿的主要成分与焦炭高温条件可以生成铜、二氧化碳和水,写出该反应的化学方程式 ?。 (2)从下列所给试剂中选择:实验步骤中试剂①为?(填代号)。 a.KMnO4? b.K2Cr2O7?c.H2O2? d.氯水 (3)在溶液B中加入CuO的作用是调节溶液pH,则pH的范围为?。 (4)由溶液C获得CuSO4.5H2O,需要经过加热蒸发浓缩、冷却结晶、过滤等操作,加热蒸发至?时停止加热。 (5)制备CaCO3时,应向CaCl2溶液中先通人(或加入)试剂②,则试剂②可以是? (填代号); a.氨水? b.盐酸? c.水蒸气? d.NaOH溶液 如果不加人试剂②,则CaCl2溶液不能与CO2反应生成CaCO3,请依据难溶电解质的沉淀溶解平衡原理分析可能的原因?。 (6)为确定试剂①的用量,需测定溶液A中Fe2+的浓度。实验操作为:准确量取20.00mL 溶液A于锥形瓶中,用0.01200 mol/L的酸性KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液15.00 mL,则溶液A中Fe2+的浓度为?。 参考答案: 本题解析:⑵双氧水是一种绿色氧化剂,不会引进杂质,因此选C。⑶加入CuO是调节溶液的pH,目的是除去溶液中的三价铁离子,而不能让铜离子沉淀,因此酸碱度应控制在3.2≤pH<4.7。⑷要利用余热将剩余的水分蒸干。⑸先要使溶液显碱性,氯化钙溶液中通入二氧化碳才能生成碳酸钙沉淀。 本题难度:一般 5、简答题 工业上用铝土矿(含氧化铝、氧化铁)制取铝的过程如下: 参考答案:(1)实现固体和液体的分离采用过滤法,实验室要洗涤Al(OH)3沉淀是在过滤器中进行的,具体操作为:漏斗中加蒸馏水至浸没沉淀,使水自然流完,重复操作2~3次, 本题解析: 本题难度:一般 | |||||||||||||||||||||||||||||||||||||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《分子式、结.. | |