1、实验题 为从草木灰(主要成分是K2CO3)中提取钾盐,某同学进行了如下操作,请填写下列空白:
⑴实验操作顺序如下:
①称量样品;②溶解沉降;③_________;④?________;⑤冷却结晶。
⑵用托盘天平称量样品时,若指针偏向右边,则表示__________(填“样品”或“砝码”)更重。
⑶在进行第③操作时,要用玻璃仪器有_______________。
⑷在进行④步操作时,要用玻璃棒不断地搅拌液体,目的是防止_____________。
参考答案:⑴过滤;蒸发
⑵砝码
⑶漏斗、烧杯、玻璃棒
⑷液体飞溅
本题解析:
本题难度:一般
2、选择题 除去括号内杂质所用试剂和方法都正确的是( )
A.NaCl(Na2CO3)----加稀盐酸,分液
B.SO2(HCl)----氢氧化钠溶液,洗气
C.NaCl溶液(碘)----四氯化碳,萃取、分液
D.KNO3溶液(KCl)----降温结晶,蒸馏
参考答案:A.分液分离能分层的物质,稀盐酸和NaCl不分层,故A错误;
B.氢氧化钠能与二氧化硫和HCl反应,加工原物质除掉,故B错误;
C.碘易溶于四氯化碳,不溶于水,可做萃取剂,故C正确;
D.KNO3和KCl的溶解度随温度变化不同,可用结晶法分离,故D正确.
故选CD.
本题解析:
本题难度:一般
3、选择题 下列物质中,分子物质的量最多的是(相对原子质量?H-1?O-16)
A.1molN2
B.1g?H2
C.0.1NAO2
D.4℃时,20mL水
参考答案:D
本题解析:分析:A、N2物质的量为1mol;
B、用质量和摩尔质量物质换算出物质的量;
C、用微粒数目和阿伏伽德罗常换算出物质的量;
D、用密度和体积计算质量,再用质量和摩尔质量物质换算出物质的量.
解答:A、N2物质的量为1mol;
B、1g?H2物质的量为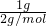 =0.5mol;
=0.5mol;
C、0.1NAO2的物质的量为: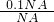 =0.1mol;
=0.1mol;
D、4℃时,20mL水的物质的量为: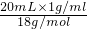 =1.11mol;
=1.11mol;
故选D.
点评:本题考查了物质的量与质量、微粒数目的换算关系和计算,同时还考查了质量、密度和体积的关系,较简单.
本题难度:简单
4、实验题 实验桌上有六瓶试剂,只知其可能为醋酸、盐酸、硫酸、氢氧化钾、氢氧化钙以及氨水。该同学取出其中两瓶,进行简易分析实验以辨识二者成分。
实验记录以下:
 实验I?从第一瓶溶液中取出25.00 mL,以标准NaOH溶液滴定,滴定结果列于表1中。
实验I?从第一瓶溶液中取出25.00 mL,以标准NaOH溶液滴定,滴定结果列于表1中。
体积(NaOH)/mL
| pH
|
5.0
| 2.2
|
10.0
| 2.4
|
| 20.0 | 3.0
|
24.0
| 3.8
|
24.8
| 4.5
|
25.0
| 7.0
|
25.2
| 9.5
|
26.0
| 10.0
|
30.0
| 10.7
|
?
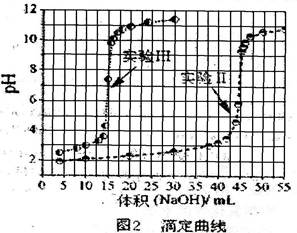
实验Ⅱ?从第一瓶溶液中取25.00 mL后,加入10.00 mL、0.01000 mol/L 的硫酸,再以同一标准NaOH溶液滴定,滴定结果绘于图2中。
实验Ⅲ?从第一瓶与第二瓶溶液中分别取出25.00 mL与10.00 mL,相互混合之后,再以标NaOH溶液滴定。滴定结果也绘于图2中。
实验IV?完成实验III后,再加入数滴BaCl2,溶液并无沉淀出现,但若改加草酸钠,则溶液出现白色沉淀。
(1)进行实验I时,若用酚酞作指示剂,判断达滴定终点对的依据是:_____________________。
(2)计算标准NaOH溶液的浓度______________mol/L。
(3)第二瓶溶液成分及其物质的量浓度_______________________、_______________mol/L。
参考答案:

本题解析:(1)滴定终点是恰好变色且30S再改变颜色。
(2)由图表中的数据直接展开计算即可。
本题难度:一般
5、选择题 现有一瓶A和B的混合物,已知它们的性质如下表。
物质
| 熔点/℃
| 沸点/℃
| 密度/g·cm—3
| 溶解性
|
A
| —11.5
| 198
| 1.11
| A、B互溶,
且均易溶于水
|
B
| 17.9
| 290
| 1.26
|
据此分析,将A和B相互分离的常用方法是?( ?)
A.过滤? B.蒸发?C.分液? D.蒸馏
参考答案:D
本题解析:
正确答案:D
A、分离固体和液体;B、分离固体溶质和液体;C、分离互不相溶的两种液体;D、正确,分离沸点不同的两种液体,大于30℃时分离效果较好。
本题难度:一般