1、计算题 标准状况下,将NO、NO2和O2的混合气体充满一烧瓶后,将烧瓶倒扣于盛满水的水槽中;一段时间后,观察到水充满整个烧瓶,若不考虑溶质进入水槽的水中,那么所得烧瓶中溶液的物质的量浓度的最大值为,最小值为。
2、实验题 某活动小组利用如图装置验证N0的还原性及探究工业生产硝酸的原理。
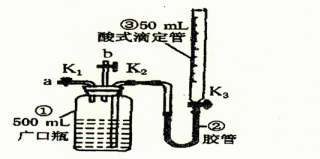
如何检查该装置气密性?。
(一)向广口瓶①中通入NO并测定NO的体积
(1)通入NO前,向广口瓶①中加入水,让水充满广口瓶①,且调节滴定管③中液面与①相平并记录滴定管③的刻度。
(2)从导管a通入一定量的NO并准确测定通入NO的体积的主要操作:?;计算出通入的NO的体积为V mL(V<50)。
(二)验证NO的还原性;探究工业生产硝酸的原理
(1)停止通入NO后关闭K1、K3,打开K2,从导管b缓缓通入O2,写出通入O2的过程中发生的化学反应方程式:?。
(2)继续通入O2,打开K3并及时调整滴定管③液面与广口瓶①中液面相平,直到广口瓶①中刚好充满液体。
I.当通入氧气的体积为V/2mL时,则广口瓶①的气体体积为?;
II.当广口瓶①的气体体积为V/2 mL时,则通入氧气的体积可能为?。
3、选择题 合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用Cu(NH3)2Ac溶液来吸收原料气中的CO,其反应是:
Cu(NH3)2Ac + CO + NH3 [Cu(NH3)3]Ac·CO + Q
[Cu(NH3)3]Ac·CO + Q
生产中必须除去原料气中CO的原因是?;Cu(NH3)2Ac溶液吸收原料气中的CO的生产适宜条件应是?。
4、填空题 (10分)氮及其化合物与人们的生活息息相关。
(1)实验室可用铜与稀硝酸反应制取NO,其离子方程式是?。
(2)已知:① CH4(g) + 4 NO2(g) =" 4" NO(g) + CO2(g) +2 H2O(g)? △H=" -574" kJ·mol-1
② CH4(g) + 4 NO(g) =" 2" N2(g) + CO2(g) + 2 H2O(g)? △H=" -1160" kJ·mol-1 根据①和②,标准状况下的4.48 L CH4恰好将NO2转化为N2时△H=??。
(3)同温同压下,3.5 L NH3恰好将3.0 LNO和NO2的混合气完全转化为N2,则原混合气中NO和NO2的体积比是? 。
(4)向含有1mol HNO3的稀硝酸中逐渐加入铁粉,所得氧化产物a、b与铁粉物质的量关系如图所示,则n3 =??p= ? ?。
?。
5、选择题 下列说法正确的是
A.常温下使品红溶液褪色的气体一定是SO2
B.常温下使湿润的KI淀粉试纸变蓝的气体一定是Cl2
C.常温下使湿润的红色石蕊试纸变蓝的气体一定是NH3
D.常温下使溴的四氯化碳溶液褪色的气体一定是C2H4