|
|
|
高中化学知识点大全《盐类水解的原理》高频试题预测(2019年最新版)(九)
2020-08-13 05:19:53
【 大 中 小】
|
1、填空题 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
实验编号
| HA物质的量浓度
(mol·L-1)
| NaOH物质的量浓度
(mol·L-1)
| 混合溶液的pH
| 甲
| 0.2
| 0.2
| pH=a
| 乙
| c
| 0.2
| pH=7
| 丙
| 0.2
| 0.1
| pH>7
| 丁
| 0.1
| 0.1
| pH=9
|
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸________________。
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2 ____(选填“是”或“否”)。混合液中离子浓度c(A-)与 c(Na+)的大小关系是_________________。
(3)丙组实验结果分析,HA是 酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是 。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)= mol·L-1。写出该混合溶液中下列算式的精确结果(不需做近似计算)。
c(Na+)-c(A-)= mol·L-1 c(OH-)-c(HA)= mol·L-1。
2、选择题 常温下,0.1 mol/L氨水溶液中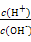 =1×10-8,下列叙述不正确的是( ) =1×10-8,下列叙述不正确的是( )
A.该溶液中氢离子的浓度:c(H+)=1×10-11 mol/L
B.0.1 mol/L氨水溶液与0.1 mol/L HCl溶液等体积混合后所得溶液中:c(N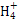 )+c(H+)=c(Cl-)+c(OH-) )+c(H+)=c(Cl-)+c(OH-)
C.0.1 mol/L的氨水溶液与0.05 mol/L H2SO4溶液等体积混合后所得溶液中:c(N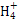 )+c(NH3)+c(NH3·H2O)=2c(S )+c(NH3)+c(NH3·H2O)=2c(S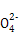 ) )
D.浓度均为0.1 mol/L的NH3·H2O和NH4Cl溶液等体积混合后,若溶液呈碱性,则c(N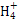 )>c(NH3·H2O)>c(Cl-)>c(OH-)>c(H+) )>c(NH3·H2O)>c(Cl-)>c(OH-)>c(H+)
|
3、选择题 下列各选项所描述的两个量中,前者一定大于后者的是
A.NH4NO3溶液中NH4+和NO3-的数目
B.纯水在80℃和25℃时的pH
C.pH与体积都相同的氨水和NaOH溶液分别用0.1 mol·L-1盐酸恰好中和,所需的盐酸体积
D.相同温度下,pH =12的NaOH溶液和Na2CO3溶液中由水电离出的c (OH-)
|
4、选择题 常温下,向10mL b mol·L-1的CH3COOH溶液中滴加等体积的0.0l mol·L-1的NaOH溶液,充分反应后溶液中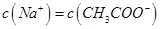 ,下列说法不正确的是
,下列说法不正确的是
A.b>0.0l
B.混合后溶液呈中性
C.CH3COOH的电离常数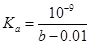 mol·L-1
mol·L-1
D.向CH3COOH溶液中滴加NaOH溶液的过程中,水的电离程度逐渐减小
5、选择题 下列叙述正确的是
A.0.1 mol·L-1氨水中,c(OH-)<c(NH4+)<0.1 mol
B.室温时10 mL0.02 mol·L-1HCl溶液与10mL0.02 mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
C.在0.1 mol·L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)-C(CH3COO-)
D.0.1 mol·L-1某二元弱酸碱性NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
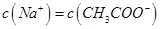 ,下列说法不正确的是
,下列说法不正确的是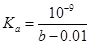 mol·L-1
mol·L-1