1、填空题 下表中的数据是破坏1mol物质中的化学键所吸收的能量(kJ).这一数据的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热,反应热等于反应中断裂旧化学键消耗的能量之和与反应中形成新化学键放出的能量之和的差.回答下列问题:
| 化学键 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2
能量(kJ)
243
193
151
432
366
298
436
|
(1)在HCl、HBr、HI中,最稳定的是______;
(2)对于反应X2+H2=2HX(X2代表Cl2、Br2、I2),相同条件下,消耗等量氢气时,放出热量最多的是______;
(3)反应Br2+H2=2HBr,当生成2mol?HBr时放出______?kJ能量.
参考答案:(1)因化学键越强,破坏物质中的化学键所吸收的能量也大,化合物也就越稳定,由表可知:在HCl、HBr、HI中,破坏1molHCl的化学键所吸收的能量最大,为432kJ,故答案为:HCl.
(2)因化学反应所吸收或放出的能量即为反应热,反应热等于反应中断裂旧化学键消耗的能量之和与反应中形成新化学键放出的能量之和的差,以氯元素为例计算断开1molCl-Cl键和H-H键需吸收能量:243kJ+436kJ=679kJ,而形成2molHCl放出的能量为2×432kJ=864 kJ,所以在Cl2+H2=2HCl反应中放出864kJ-679kJ=185kJ的热量,同理可计算在Br2+H2=2HBr、I2+H2=2HI反应中分别放出103kJ、9kJ的热量.故答案为:Cl2;
(3)反应Br2+H2=2HBr中,断开1molBr-Br键和H-H键需吸收能量:193kJ+436 kJ=629 kJ,而形成2molHBr放出的能量为2×366 kJ=732 kJ,所以在Cl2+H2=2HCl反应中放出732kJ-629kJ=103kJ的热量,故答案为:103.
本题解析:
本题难度:一般
2、选择题 已知热化学反应方程式:
Zn(s)+1/2O2(g) ZnO(s);ΔH="-351.5" kJ·mol-1
ZnO(s);ΔH="-351.5" kJ·mol-1
Hg(l)+ 1/2O2(g)  HgO(s);ΔH="-90.84" kJ·mol-1
HgO(s);ΔH="-90.84" kJ·mol-1
则锌汞电池中热化学反应方程式:Zn(s)+HgO(s)  ZnO(s)+Hg(l)的ΔH为
ZnO(s)+Hg(l)的ΔH为
A.ΔH="+260.7" kJ·mol-1
B.ΔH="-260.7" kJ·mol-1
C.ΔH="-444.2" kJ·mol-1
D.ΔH="+444.2" kJ·mol-1
参考答案:B
本题解析:略
本题难度:一般
3、选择题 下列说法中,不准确的是
A.燃烧不一定需要氧气,但燃烧一定是放热反应
B.化学反应中的能量变化都只表现为热量变化
C.为保证燃料充分燃烧,通入的空气要适当过量而不是越多越好
D.将煤气化和液化,可以提高煤的利用率
参考答案:B
本题解析:略
本题难度:简单
4、选择题 已知热化学方程式:SO2(g)+ 1/2O2(g) 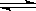 ?SO3(g)?△H = -98.32kJ/mol,在容器中充入2molSO2?和1molO2充分反应,最终放出的热量为
?SO3(g)?△H = -98.32kJ/mol,在容器中充入2molSO2?和1molO2充分反应,最终放出的热量为
A.小于196.64kJ
B.196.64kJ/mol
C.196.64kJ
D.大于196.64kJ
参考答案:A
本题解析:由于是可逆反应,所以反应中不可能生成2mol三氧化硫,因此放出的热量小于196.64kJ,答案选A。
本题难度:一般
5、选择题 有关下列各组热化学方程式中关系说法正确的是
2H2(g)+O2(g)=2H2O(g);?△H1= -Q1kJ/mol
2H2(g)+O2(g)=2H2O(1);?△H2= -Q2kJ/mol
H2(g)+1/2O2(g)=H2O(1);△H3= -Q3kJ/mol
A.△H1=△H2
B.△H1<△H2
C.Q1 >2Q3
D.△H1>2△H3
参考答案:D
本题解析:水蒸气变成液态水要放出热量,故Q1<Q2,-Q1>-Q2,△H1>△H2,故A和B均错误,由方程式②和③的系数关系可得Q2=2Q3,即△H2=2△H3,故Q1<2Q3,△H1>2△H3,D正确;故选D。
本题难度:一般