1、选择题 自来水是用氯气杀菌消毒的,不法商贩用自来水冒充纯净水销售,为辨别纯净水真伪,可用下列哪种试剂鉴别
A.酚酞试液
B.氯化铁溶液
C.硝酸银溶液
D.氢氧化钠溶液
参考答案:C
本题解析:因纯净水销售中不含氯离子,而自来水中含氯离子,所以向两样品中加入硝酸银溶液,变浑浊的自来水,反之是纯净水,故选:C.
本题难度:简单
2、选择题 把一定量的Na2O2和NaHCO3混合粉末分为两等份,将其中一份加入到100mL稀盐酸中恰好完全反应,生成干燥的气体2.24L(标准状况),再将此气体通入到另一份混合物中,充分反应后,气体减少为2.016L(标准状况),则原混合粉末中Na2O2和NaHCO3的物质的量之比及原稀盐酸的物质的量浓度可能是
A.A
B.B
C.C
D.D
参考答案:AD
本题解析:分析:第一份发生反应①2Na2O2+4HCl=4NaCl+2H2O+O2 ;②NaHCO3+HCl=NaCl+H2O+CO2,生成气体为O2与CO2.
将第一份生成的干燥气体,通入第二份Na2O2的NaHCO3的混合粉末,发生反应2Na2O2+2CO2=2Na2CO3+O2,根据二氧化碳是否过量用讨论的方法计算.
解答:2.24L混合气体的物质的量为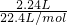 =0.1mol;
=0.1mol;
2.016LO2的物质的量为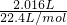 =0.09mol.
=0.09mol.
2Na2O2+2CO2=2Na2CO3+O2 △n
2 2 1
n m 0.1mol-0.09mol=0.01mol
n=m=0.02mol,
(1)若CO2完全反应,则第一份生成CO2的为0.02mol,O2为0.1mol-0.02mol=0.08mol
2 Na2O2+4 HCl=4NaCl+2H2O+O2
0.16mol 0.32mol 0.08mol
NaHCO3+HCl=NaCl+H2O+CO2
0.02mol 0.02mol 0.02mol
所以Na2O2为0.16mol,NaHCO3为0.02mol;混合物中Na2O2与NaHCO3的物质的量之比0.16mol:0.02mol=8:1;
消耗的HCl为0.32mol+0.02mol=0.34mol,物质的量浓度为 =3.4mol/L.
=3.4mol/L.
(2)若CO2未完全反应,则Na2O2应是0.02 mol,
2Na2O2+4HCl=4NaCl+2H2O+O2
0.02mol 0.04mol 0.01mol
则第一份生成O2的为0.01mol,所以CO2为0.1mol-0.01mol=0.09mol.
NaHCO3+HCl=NaCl+H2O+CO2
0.09mol 0.09mol 0.09mol
所以Na2O2为0.02mol,NaHCO3为0.09mol;混合物中Na2O2与NaHCO3的物质的量之比0.02mol:0.09mol=2:9.
消耗的HCl为 0.04mol+0.09mol=0.13mol,物质的量浓度为 =1.3mol/L.
=1.3mol/L.
故选AD.
点评:本题考查化合物的计算,题目难度中等,注意利用端值法结合相关反应的方程式计算该题.
本题难度:困难
3、选择题 下列说法正确的是
A.氮化硅、氧化铝均为高温结构材料
B.汽油、乙烯均为石油分馏产品
C.明矾、漂白粉均为自来水消毒剂
D.光导纤维、涤纶均为合成高分子材料
参考答案:A
本题解析:分析:A.氮化硅、氧化铝熔点很高,可以做高温结构材料;
B.乙烯是石油裂解的产品;
C.明矾可以净水,但不能杀菌消毒;
D.光导纤维主要成分是二氧化硅,不是高分子材料.
解答:A.氮化硅、氧化铝熔点很高,可以做高温结构材料,故A正确;
B.汽油是石油分馏产品,乙烯是石油裂解的产品,故B错误;
C.明矾水解生成氢氧化铝胶体,吸附悬浮物质,起净水作用,但不能杀菌消毒,漂白粉具有强氧化性,可以作自来水消毒剂,故C错误;
D.光导纤维主要成分是二氧化硅,不是高分子材料,故D错误;
故选A.
点评:本题考查石油炼制、新型材料、铝及氯的重要化合物性质与用途等,比较基础,旨在考查学生对基础知识的全面掌握.
本题难度:困难
4、选择题 下表各组物质中,满足下图物质一步转化关系的选项是
A.Na? NaOH? NaHCO3
B.Cu? CuSO4? Cu(OH)2
C.C CO CO2
D.Si? SiO2? H2SiO3
参考答案:C
本题解析:分析:A、Na和水反应生成NaOH,NaOH与二氧化碳反应生成NaHCO3,NaHCO3不能直接得到Na;
B、Cu(OH)2不能直接得到Cu;
C、C与少量的氧气反应得到CO,CO与氧气反应得到 CO2,CO2与Mg反应可以得到C;
D、SiO2与水不反应.
解答:A、Na和水反应生成NaOH,NaOH与二氧化碳反应生成NaHCO3,NaHCO3不能直接得到Na,故A错误;
B、Cu与浓硫酸反应可以得到CuSO4,CuSO4与氢氧化钠等反应生成Cu(OH)2,Cu(OH)2不能直接得到Cu,故B错误;
C、C与少量的氧气反应得到CO,CO与氧气反应得到 CO2,CO2与Mg反应可以得到C,故C正确;
D、Si与氧气在一定条件下可以反应生成SiO2,SiO2与水不反应,制取H2SiO3,应由硅酸盐和酸反应制备,故D错误;
故选C.
点评:本题考查元素化合物知识,难度不大,本题注意把握常见物质的性质,学习中注重相关基础知识的积累.
本题难度:困难
5、选择题 现有下列物质?①2.3g?Na?②6.2g?Na2O?③7.8g?Na2O2?④4.0g?NaOH,把它们分别放入100g水中,对所得的溶液的质量分数中正确的是
A.③>②>①>④
B.③=②>①>④
C.④>③>②>①
D.③=②>④=①
参考答案:B
本题解析:分析:先根据化学反应方程式确定溶质,再根据溶液质量的变化计算质量分数.
解答:①2.3g?Na与水反应生成氢氧化钠和氢气,所以溶液中溶质是氢氧化钠;根据化学式Na→NaOH知,生成氢氧化钠的质量为4g,溶液的质量=钠和水的质量-氢气的质量=2.3g+100g-0.1g=102.2g,所以该溶液的质量分数 ;
;
②6.2g?Na2O与水反应生成氢氧化钠,溶液中的溶质是氢氧化钠;根据化学式Na2O→NaOH知,生成氢氧化钠的质量为8g,溶液的质量=氧化钠和水的质量=6.2g+100g=106.2g,所以该溶液的质量分数为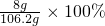 =7.5%;
=7.5%;
?③7.8g?Na2O2与水反应生成氢氧化钠和氧气,所以溶液中的溶质是氢氧化钠;根据化学式Na2O2→NaOH知,生成氢氧化钠的质量为8g,溶液的质量=过氧化钠+水的质量-氧气的质量=7.8g+100g-1.6g=106.2g,所以该溶液的质量分数为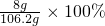 =7.5%;
=7.5%;
?④4.0g?NaOH溶于水和水不反应,所以溶液的溶质为氢氧化钠,溶液的质量=氢氧化钠的质量+水的质量=4.g+100g=104g,所以溶液的质量分数为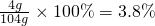 .
.
所以溶液的质量分数正确的是③=②>①>④,故选B.
点评:本题考查了物质之间的反应及溶液溶质的判断,难度不大,要注意溶液质量的计算,正确确定溶质的质量、溶液的质量是解本题的关键.
本题难度:困难