1、选择题 以下鉴别Na2CO3和NaHCO3两种固体的方法中错误的是( ? )
A.将加热两种固体产生的气体通入澄清石灰水中
B.将两种固体配成稀溶液,分别加入稀CaCl2溶液
C.将两种固体配成稀溶液,分别加入Ba(OH)2溶液
D.在两种固体中分别加入同浓度的盐酸,看产生气泡的速率
参考答案:C
本题解析:试题分析:碳酸钠受热不分解、碳酸氢钠受热分解生成二氧化碳气体使澄清石灰水变浑,A正确;碳酸钠与氯化钙生成碳酸钙沉淀,碳酸氢钠与氯化钙不反应,B正确;碳酸钠和碳酸氢钠均能与氢氧化钡生成碳酸钡沉淀,C错误;碳酸钠溶液和碳酸氢钠溶液分别与盐酸反应,碳酸氢钠更快,D正确。
考点:元素化合物
点评:碳酸氢钠与氢氧化钡溶液反应方程式为NaHCO3+Ba(OH)2=BaCO3↓+NaOH+H2O或2NaHCO3+Ba(OH)2=BaCO3↓+Na2CO3+2H2O。
本题难度:困难
2、选择题 下列物质中既能跟稀H2SO4反应, 又能跟氢氧化钠溶液反应的是:
①NaHCO3?②Al2O3? ③Al(OH)3? ④Al
A.③④
B.②③④
C.①③④
D.全部
参考答案:D
本题解析:试题分析:既能与稀硫酸反应又能与NaOH溶液反应的物质是具有两性的物质或弱酸的酸式盐,所以上述物质全部符合,答案选D。
考点:物质的性质
点评:本题容易把弱酸的酸式盐忽略。
本题难度:一般
3、选择题 下列物质中,常温下呈液态的是
A.I2
B.MgCl2
C.Br2
D.SO2
参考答案:C
本题解析:分析:I2和MgCl2在常温下呈固态,Br2为液态,SO2为气态.
解答:A.I2在常温下呈固态,为紫色固体,故A不选;
B.MgCl2在常温下呈固态,为无色固体,故B不选;
C.在常温下,Br2为红棕色液体,故C选;
D.在常温下,SO2为无色气体,故D不选.
故选C.
点评:本题考查常见物质的物理性质,题目难度不大,注意常见元素化合物的性质,注重相关基础知识的积累.
本题难度:一般
4、选择题 某溶液中存在较多的H+、SO42-、NO3-,则该溶液中还可能大量存在的离子组是
A.Mg2+、NH4+、Cl-
B.Mg2+、Ba2+、Br-
C.Na+、Cl-、I-
D.Al3+、HCO3-、Cl-
参考答案:A
本题解析:试题分析:A中的离子可以和溶液中的H+、SO42-、NO3-共存;B中Ba2+溶液中SO42-形成沉淀;C中Cl-、I-会被溶液中的硝酸氧化;D中的HCO3-和溶液中的H+反应,不能共存。
考点:离子共存
本题难度:简单
5、选择题 下列离子方程式正确的是
A.氯化铝溶液中加入过量氨水:AlCl3++4NH3?H2O=AlO2-+4NH4++2H2O
B.将氯气溶于水制备次氯酸:Cl2+H2O2H++C1-+ClO-
C.用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+
D.NaHSO4溶液中滴入Ba(OH)2溶液至SO42-完全沉淀:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
参考答案:C
本题解析:分析:A.氨水不能溶解氢氧化铝沉淀;
B.次氯酸为弱酸,在离子反应中应保留化学式;
C.遵循质量守恒定律和电荷守恒;
D.NaHSO4溶液中滴入Ba(OH)2溶液至SO42-完全沉淀,二者的物质的量之比为1:1.
解答:A.氯化铝溶液中加入过量氨水的离子反应为Al3++3NH3?H2O=Al(OH)3↓+3NH4+,故A错误;
B.将氯气溶于水制备次氯酸的离子反应为Cl2+H2O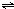 H++C1-+HClO,故B错误;
H++C1-+HClO,故B错误;
C.用FeCl3溶液腐蚀铜线路板的离子反应为Cu+2Fe3+=Cu2++2Fe2+,故C正确;
D.NaHSO4溶液中滴入Ba(OH)2溶液至SO42-完全沉淀的离子反应为H++SO42-+Ba2++OH-=BaSO4↓+H2O,故D错误;
故选C.
点评:本题考查离子反应方程式书写的正误判断,明确发生的化学反应、离子反应的书写方法是解答本题的关键,难度不大.
本题难度:简单