1、选择题 现有装有物质的量浓度为1.2 mol/L的盐酸100ml的容器甲和装有物质的量浓度为1mol/L的硫酸100ml的容器乙,向甲.乙容器内加入相同质量的铝,充分反应后生成氢气的体积比为3:4(标准状况下),问所加入的铝的质量是( ?)
A.1.08克
B.1.44克
C.1.8 克
D.无法计算
参考答案:B
本题解析:HCl的物质的量为0.12mol,H2SO4的物质的量为0.1mol,若Al足量,生成氢气的体积比为3:5,若HCl、H2SO4足量,Al完全反应,生成氢气的体积比为1:1,实际生成氢气的体积比为3:4,说明Al在盐酸中有剩余,而在硫酸中完全反应,HCl完全反应生成的氢气为1/2×0.1L×1.2mol?L?1=0.06mol,则Al与硫酸完全反应生成的氢气为0.06mol×4/3=0.08mol,根据2Al~3H2,可得m(Al)=0.08mol×2/3×27g/mol=1.44g,故B项正确。
本题难度:一般
2、选择题 下列说法中正确的是
A.标准状态下,1mol水的体积约为22.4L
B.1 mol某气体的体积为22.4 L,该气体所处的状况必定为标准状况
C.通常状态下,1 mol某气体的体积约为22.4 L,该气体的压强为101 kPa
D.在0℃、1.01×105 Pa时,某气体的体积约为2.24×10-2 m3,该气体的物质的量为1 mol
参考答案:D
本题解析:略
本题难度:简单
3、填空题 ①等物质的量的CO和CO2所含原子个数比为 ,质量比为 。
②含硫原子数相同的SO2和SO3的物质的量之比是 ;含氧原子数相同的SO2和SO3的质量之比是 ,物质的量之比是 。
参考答案:①2:3、 7:11 ② 1:1、 6:5、 3 :2
本题解析:①等物质的量的CO和CO2分子个数比为1:1,故原子个数比为2:3;质量比等于摩尔质量之比,故质量比为28:44=7:11,答案为2:3;7:11;②SO2和SO3分子中均含有一个硫原子,故含硫原子数相同的SO2和SO3的物质的量之比是1:1;含氧原子数相同的SO2和SO3的物质的量比3:2,则质量比为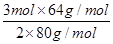 =6:5,答案为1:1;6:5;3:2.
=6:5,答案为1:1;6:5;3:2.
考点:物质的量的有关计算
本题难度:一般
4、计算题 (5分)同温同压下,若A容器中充满O2 ,B容器中充满O3。
(1)若所含分子总数相等,则A容器和B容器的容积之比是?
(2)若两容器中所含原子总数相等,则A容器和B容器的容积比是?
(3)若两容器的体积比为5∶2,则O2和O3物质的量之比为_________,质量之比为_______,密度之比为______________。
参考答案:(1) 1:1? (2) 3:2?(3) 5∶2?5∶3?2∶3
本题解析:(1)分子总数相等,则O2和O3的物质的量相等,体积也相等,则A容器和B容器的容积之比是1:1。
(2)两容器中所含原子总数相等,则O2和O3的分子数之比为3:2,物质的量之比为3:2,体积之比为3:2,则A容器和B容器的容积之比是3:2。
(3)两容器的体积比为5∶2,则O2和O3物质的量之比为5:2,质量之比为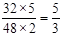 ,密度比等于摩尔质量之比等于2:3。
,密度比等于摩尔质量之比等于2:3。
点评:本题主要考查物质的量基本公式,非常简单基础。
本题难度:一般
5、选择题 MgCl2、KCl、K2SO4 3种盐配成混合液后,若溶液中n(K+)=1.5 mol、
n(Mg2+)=0.5 mol、n(Cl-)=1.5 mol,则溶液中n(SO42-)应为
A.0.5 mol
B.0.25 mol
C.0.15 mol
D.1 mol