1、填空题 A、B、C、D代表元素周期表中4种元素,请完成下列问题
(1)A元素的基态原子的最外层有3个未成对电子,次外层有2个电子,该元素氢化物比同族元素氢化物熔沸点高的原因是?;第一电离能比后面一号元素大的原因是?
(2)B元素与氧元素形成的一种化合物是含有4个原子18个电子的分子,该化合物的电子式为?,若向该化合物的稀溶液中加入少量二氧化锰,有无色气体产生,该反应的化学方程式为?
(3)C元素的正三价离子的 3d轨道为半充满状态,C元素的符号为?,在同期表中位于?周期?族,原子结构示意图为?
(4)D元素位于元素周期表第四周期第ⅠB族,其基态原子的电子排布式为?
参考答案:⑴NH3分子间有氢键;第一电离能不O大的原因是 N原子的2P轨道是半充满的较稳定状态;
⑵ 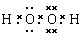 ; 2H2O2
; 2H2O2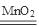 2H2O+O2↑
2H2O+O2↑
⑶Fe,位于第四周期Ⅷ族,原子结构示意图 ?⑷1s22s22p63s23p63d104s1或[Ar] 3d104s1
?⑷1s22s22p63s23p63d104s1或[Ar] 3d104s1
本题解析:根据题意可知:A是N;其相应的氢化物NH3的熔沸点比同族元素氢化物熔沸点高是因为在NH3分子间除了存在一般的分子间作用力外,还存在有氢键,增加了分子之间的相互作用。一般情况下,同一周期的元素,元素的原子序数越大,元素的非金属性越强,原子半径越小,失去电子越难,第一电离能越大,但是由于N原子2P轨道处于半充满的稳定状态,所以比O元素的第一电离能大。(2)B元素是H,它与O形成的18个电子的分子是H2O2,电子式为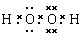 ;H2O2在MnO2催化作用下反应的化学方程式为2H2O2
;H2O2在MnO2催化作用下反应的化学方程式为2H2O2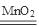 2H2O+O2↑;(3)C元素的正三价离子核外电子排布为1s22s22p63s23p63d5,则C是26号元素Fe,该元素在周期表中位于第四周期Ⅷ族,原子结构示意图为
2H2O+O2↑;(3)C元素的正三价离子核外电子排布为1s22s22p63s23p63d5,则C是26号元素Fe,该元素在周期表中位于第四周期Ⅷ族,原子结构示意图为 ;(4)D元素是29号元素Cu,其基态原子的电子排布式为1s22s22p63s23p63d104s1或[Ar] 3d104s1
;(4)D元素是29号元素Cu,其基态原子的电子排布式为1s22s22p63s23p63d104s1或[Ar] 3d104s1
本题难度:一般
2、选择题 X元素原子的质量数为m,核内中子数为n,则wgx+含有电子的物质的量是(?)
A.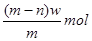
B.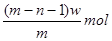
C.
D.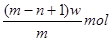
参考答案::B
本题解析:先根据质子数=质量数—中子数计算质子数,再根据阳离子中核外电子数=质子数-
电荷数计算一个阳离子含有的电子数,然后根据n=" m/M" 计算含有电子的物质的量。
解:该离子中含有的质子数=质量数-中子数=m-n,阳离子中核外电子数=质子数-电荷数=m-n-1;数值上,核素的相对原子质量等于其质量数,所以
wg?X+离子含有的电子的物质的量=" (w/m" )×(m-n-1)=(m-n-1)w/m? mol.
故选B。
点评:本题考查了阳离子中核外电子数的计算,注意:核素的相对原子质量在数值上等于其质量数。
本题难度:一般
3、选择题 人类探测月球发现,在月球的土壤中含有较丰富的质量数为3的氦,它可以作为未来核聚变的重要原料之一。氦的该种同位素应表示为?
A. He
He
B.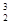 He
He
C.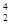 He
He
D.He
参考答案:B
本题解析:同位素应表示是He,氦是2号元素,质子数为2。
本题难度:一般
4、选择题 下列性质的递变规律不正确的是
A.NaOH、KOH、CsOH碱性依次增强
B.Li、Na、K、Rb、Cs的失电子能力逐渐增强
C.Al3+、Mg2+、Na+的离子半径依次减小
D.F2、Cl2、Br2、I2的熔沸点依次升高、密度依次增大
参考答案:C
本题解析:考查元素周期律知识
A.同主族元素自上面下,金属性增强,对应的最高价氧化物的水化物的碱性增强,正确
B.同主族元素自上面下,金属性增强,失电子能力逐渐增强,正确
C.三离子的核外电子均为两层,核电荷数越小,半径越大,不正确
D.卤素单质均为分子晶体,分子量越大,熔沸点越高,密度越大,正确
答案为C
本题难度:一般
5、填空题 (10分)短周期元素A、B、C、D中,0.5mol A元素的离子得到6.02×1023个电子被还原为中性原子,0.4g A的氧化物恰好与100ml 0.2mol/L的盐酸完全反应,A原子核内质子数目与中子数目相等,B元素原子核外第三层电子数目比第一层多1个,C―比A元素的离子多1个电子层,D元素的原子核外第二层比第一层多2个电子。回答下列问题:
(1)A元素的名称是_______;
(2)C―的结构示意图为?;D元素在周期表中的位置是__________;
(3)元素D的气态氢化物的电子式为____,其分子的结构特点是具有_____结构,在一定条件下该氢化物可与单质C发生取代反应,若将等物质的量的该氢化物与单质C混合,在一定条件下充分反应后,生成物中物质的量最大的是_______(用化学式填写);
(4)工业上冶炼单质A的化学方程式为_____________________________________;
(5)工业上常用单质B冶炼难熔的金属,写出氧化铁和单质B在高温下反应的化学方程式_______,若反应中有0.25mol氧化铁参加反应反应中转移电子的个数为__________;
(6)若将单质A、B用导线连接插入到氢氧化钠溶液中可以组成原电池,则正极材
料是_______(用化学式填写),负极电极反应是___________________________________。
参考答案:(1)镁? (2) 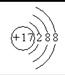 ;第二周期、ⅣA? (3)
;第二周期、ⅣA? (3)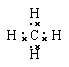 、正四面体? HCl?
、正四面体? HCl?
(4) MgCl2(熔融)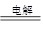 Mg+Cl2↑?(5)Fe2O3+2Al
Mg+Cl2↑?(5)Fe2O3+2Al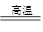 Al2O3+2Fe? 9.03×1023
Al2O3+2Fe? 9.03×1023
(6)Mg? 2Al-6e-+8OH-=2AlO2-+4H2O
本题解析:根据元素的性质和在周期表中的位置可知,B是铝元素,D是碳元素。0.5mol A元素的离子得到6.02×1023个电子被还原为中性原子,说明A的最高价是+2价。100ml 0.2mol/L的盐酸是0.02mol,所以氧化物的物质的量是0.01mol,乙醇相对分子质量是40,即A的质量数是24. A原子核内质子数目与中子数目相等,所以A是镁,则C是氯元素。
(3)甲烷是具有正四面体结构分子,其电子式为 。甲烷中含有4个氢原子,所以生成物中含量最多的是氯化氢。
。甲烷中含有4个氢原子,所以生成物中含量最多的是氯化氢。
(4)镁是活泼的金属,通过电解熔融的氯化镁生成镁,方程式为MgCl2(熔融)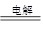 Mg+Cl2↑。
Mg+Cl2↑。
(5)铝是活泼的金属,发生铝热反应的方程式为Fe2O3+2Al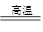 Al2O3+2Fe。氧化铁中铁的化合价是+3价的,所以0.25mol氧化铁参加反应转移的电子为0.25mol×3×2=1.5mol,其电子数为1.5mol×6.02×1023=9.03×1023。
Al2O3+2Fe。氧化铁中铁的化合价是+3价的,所以0.25mol氧化铁参加反应转移的电子为0.25mol×3×2=1.5mol,其电子数为1.5mol×6.02×1023=9.03×1023。
(6)由于铝和氢氧化钠溶液反应,所以作负极是铝,镁作正极。负极反应式为2Al-6e-+8OH-=2AlO2-+4H2O。
本题难度:一般