1、选择题 氢化亚铜(CuH)是一难溶物质,用CuSO4溶液和“另一种反应物”在40℃~50℃时反应可生成它。
CuH不稳定,易分解;CuH在氯气中能燃烧;CuH跟盐酸反应能产生气体。以下有关推断中不正确的是
[? ]
A.“另一种反应物”在反应中表现还原性
B.CuH在化学反应中既可做氧化剂也可做还原剂
C.CuH在氯气中燃烧的化学方程式为
D.CuH与盐酸反应生成的气体是H2
参考答案:C
本题解析:
本题难度:一般
2、简答题 某同学将擦亮的镁条投入到硫酸铜溶液中,在反应的过程中观察到一些现象:
①______?②有黑色固体在镁条表面及烧杯底部生成
③有少量蓝色沉淀生成.请完成下列问题:
(1)将现象①补充完整.
(2)该同学猜想黑色固体是铜或氧化铜与铜的混合物,设计如下实验:
可供选择的试剂:A、稀硫酸?B、稀硝酸?C、浓硝酸?D、硝酸银溶液
步骤一:取洗涤、晾干后的黑色固体样品,向其中加入足量的______(填字母),微
热使之充分反应,黑色固体未溶解.
步骤二:将步骤一所得液体过滤、洗涤、晾干后,再加入______(填字母),观察到
溶液呈现蓝色.
(3)镁片与硫酸铜溶液发生反应的两个主要的离子方程式:______、______.
参考答案:(1)硫酸铜为强酸弱碱盐,溶液呈酸性,镁与氢离子反应生成氢气,镁条表面产生气泡.
故答案为:镁条表面产生气泡.
(2)铜与氧化铜都能溶液硝酸,选择硝酸无法验证黑色固体成分,故步骤一选择稀硫酸,黑色固体溶解则为氧化铜,不溶解为铜,部分溶解为氧化铜与铜的混合物;
黑色固体未溶解,说明黑色固体为铜,铜能与硝酸、硝酸银溶液反应,故步骤二可再加入稀硝酸或浓硝酸或硝酸银溶液.
故答案为:A;B或C或D.
(3)镁与铜离子反应置换铜,反应离子方程式为?Mg+Cu2+=Mg2++Cu;
硫酸铜溶液,铜离子水解呈酸性,镁与氢离子反应生成氢气,氢离子浓度降低,促进铜离子水解生成氢氧化铜沉淀,反应离子方程式为Mg+Cu2++2H2O=Mg2++Cu(OH)2↓+H2↑.
故答案为:Mg+Cu2+=Mg2++Cu;Mg+Cu2++2H2O=Mg2++Cu(OH)2↓+H2↑.
本题解析:
本题难度:一般
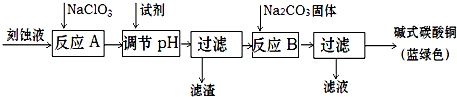
3、简答题 碱式碳酸铜是一种用途广泛的化工原料.工业上可用酸性刻蚀废液(主要含有Cu2+、Fe2+、Fe3+、H+、Cl-)制备,其制备过程如下:
Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3
开始沉淀pH
4.2
5.8
1.2
完全沉淀pH
6.7
8.3
3.2
|
(1)滤渣的主要成分是______(写化学式).
(2)调节反应A后溶液的pH范围应为______.选择的试剂最合适的是______(填序号).
a.氨水b.稀硫酸c.氢氧化钠d.碳酸铜
(3)反应B的温度如过高,则所得蓝绿色产品中可能会出现的杂质是______.
(4)将Na2CO3溶液滴入到一定量CuCl2溶液中得到沉淀.用相应的离子方程式表示:
①沉淀只有CuCO3:______;
②沉淀只有Cu(OH)2且放出气泡:______.
(5)碱式碳酸铜的组成可表示为:aCuCO3?bCu(OH)2?cH2O.要测定其组成,甲同学设计的实验方案中需要如下五个步骤:①称量样品的质量;②高温分解;③测出CO2的质量;④测出水蒸汽的质量;⑤称量CuO的质量.而乙同学认为除步骤②外,实验只需测定四个量中的三个即可,则合理的组合为______(填序号,写一组即可).
参考答案:由流程图可知:刻蚀废液加入NaClO3把Fe2+氧化为Fe3+,调节pH除掉铁离子,滤渣为Fe(OH)3,向CuCl2溶液中加入碳酸钠固体,过滤得到碱式碳酸铜.
(1)滤渣为铁离子完全沉淀得到的氢氧化铁沉淀,故答案为:Fe(OH)3;
(2)调节pH使得铁离子沉淀完全,而铜离子不能开始沉淀,调节反应A后溶液的pH范围应为3.2-4.2;氨水氢氧化钠均引入杂质离子,加入硫酸不能使pH升高,为了不引入杂质,最合适的碱性物质是碳酸铜,
故答案为:3.2-4.2;d;
(3)反应B的温度如过高,碳酸铜和氧化铜均可受热分解生成氧化铜,故答案为:CuO;
(4)将Na2CO3溶液滴入到一定量CuCl2溶液中得到沉淀,Cu2+和CO32-生成CuCO3沉淀,离子方程式为:Cu2++CO32-=CuCO3↓,Cu2+和CO32-和水反应生成Cu(OH)2沉淀和二氧化碳,离子方程式为:Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑,
故答案为:①Cu2++CO32-=CuCO3↓;②Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑;
(5)碱式碳酸铜的组成可表示为:aCuCO3?bCu(OH)2?cH2O.分解产物有三部分组成:二氧化碳、CuO、水,要测定其组成,步骤①称量样品的质量必须知道,步骤③测出CO2的质量④测出水蒸汽的质量⑤称量CuO的质量三个数据知道其中的任意两个即可,另一部分的数据可由样品的质量和已知两部分的质量求得,
故答案为:①③④(或①③⑤、①④⑤).
本题解析:
本题难度:一般
4、选择题 在25℃时,有80g饱和Ba(OH)2溶液,向其中加入纯BaO粉末a?g,反应后温度恢复到25℃,下列有关该溶液的说法正确的是
A.溶液中c(Ba2+)将增大
B.溶液的pH将增大
C.溶液中Ba2+的物质的量将减少
D.溶液中c(OH-)减少
参考答案:C
本题解析:分析:80g饱和Ba(OH)2溶液,向其中加入纯BaO粉末a?g,BaO粉末与水反应生成Ba(OH)2,消耗水,溶液有Ba(OH)2析出,恢复至原温度25℃,溶液浓度不变,仍为饱和溶液,据此即可解答.
解答:A.BaO和水发生:BaO+H2O=Ba(OH)2消耗水,饱和的Ba(OH)2溶液中有Ba(OH)2析出,溶液中Ba2+数目减少,但反应后仍为饱和溶液,溶液的pH不变,溶液中c(Ba2+)不变,故A错误;
B.BaO和水发生,恢复至原温度,析出Ba(OH)2,仍为饱和溶液,溶液浓度不变,溶液的pH不变,故B错误;
C.BaO和水发生,消耗水,有Ba(OH)2析出,溶液中Ba2+数目减少,故C正确;
D.BaO和水发生,恢复至原温度,析出Ba(OH)2,仍为饱和溶液,溶液浓度不变,溶液中c(OH-)不变,故D错误;
故选C.
点评:本题考查BaO与水的反应,以及饱和溶液的性质,注意饱和溶液的性质,当溶剂减小,溶液中要析出晶体,但溶液的浓度不变.题目难度不大.
本题难度:一般
5、简答题 实验室常用铜片、稀硫酸和浓硝酸来制备五水硫酸铜:Cu+2HNO3+H2SO4=CuSO4+2NO2↑+2H2O分以下几个步骤:
①将盛有4.5g铜屑的蒸发皿置于酒精灯火焰上,灼烧至表面呈现黑色,冷却;
②加16mL3mol?L-1硫酸,再缓慢、分批加入7mL12mol?L-1硝酸(在通风橱进行);
③待反应缓和后,盖上表面皿,用水浴加热至铜屑全溶;
④倾析法趁热将溶液转移到另一蒸发皿中,并在水浴上浓缩到溶液出现晶膜,冷却,过滤;
…
请回答下列问题:
(1)将铜屑灼烧的目的是______,表面的黑色物质是______.
(2)加入硝酸时,必须缓慢、分批加入的目的是______.
(3)控制硝酸总量尽可能小除了环保和节约原料外,还可能的原因是______.
(4)下图是硫酸铜和硝酸铜的溶解度表(单位:g),请根据表回答:
温度/℃
0
20
40
60
80
100
CuSO4?5H2O
23.1
32.0
44.6
61.8
83.8
114.0
Cu(NO3)2?xH2O
83.5
125.0
163.0
182.0
208.0
247.0