1、选择题 3 g镁铝合金与100 mL稀硫酸恰好完全反应,将反应后的溶液加热蒸干,得到无水硫酸盐17.4 g,则原硫酸的物质的量浓度为? ( )。
A.1 mol·L-1
B.1.5 mol·L-1
C.2 mol·L-1
D.2.5 mol·L-1
参考答案:B
本题解析:由镁铝合金到无水硫酸盐,固体增加的质量为SO42-的质量,则n(H2SO4)=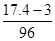 mol=0.15 mol,故c(H2SO4)=
mol=0.15 mol,故c(H2SO4)= =1.5 mol·L-1,B对。
=1.5 mol·L-1,B对。
本题难度:一般
2、选择题 将Na2O2逐渐加入到含有Al3+、Mg2+、NH4+的混合溶液中并加热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系如图所示。

则原溶液中Al3+、Mg2+、NH4+的物质的量分别为 ( ?)
A.2 mol、3 mol、8 mol
B.3 mol、2 mol、8 mol
C.2 mol、3 mol、4 mol
D.3 mol、2 mol、4 mol
参考答案:C
本题解析:
加入8molNa2O2时,根据钠原子守恒,可知n(Na+)=2n(Na2O2)=2×8mol=16mol,Na+离子所带的总电量相当于16mol×1=16mol.
A、Al3+、Mg2+、NH4+离子所带的总电量相当于2mol×3+3mol×2+8mol×1=20mol,故A错误;
B、Al3+、Mg2+、NH4+离子所带的总电量相当于3mol×3+2mol×2+8mol×1=21mol,故B错误;
C、Al3+、Mg2+、NH4+离子所带的总电量相当于2mol×3+3mol×2+4mol×1=16mol,故C正确;
D、Al3+、Mg2+、NH4+离子所带的总电量相当于3mol×3+2mol×2+4mol×1=17mol,故D错误.
故选C.
本题难度:困难
3、选择题 小明家中收藏了一件200年前的铝制佛像,该佛像至今仍保存完好。该佛像未锈蚀的主要原因是
[? ]
A.铝不易发生化学反应
B.铝不易被氧化
C.铝的氧化物容易发生还原反应
D.铝易被氧化,但氧化生成的氧化铝具有保护内部铝的作用
参考答案:D
本题解析:
本题难度:简单
4、选择题 向a mL AlCl3溶液中加入稍过量的NaOH溶液 b mL,使沉淀中与溶液中含铝元素的物质的量相等。若AlCl3与NaOH的物质的量浓度相等,则a∶b等于
A.2∶7
B.2∶1
C.2∶3
D.2∶5
参考答案:A
本题解析:由题目要求可知,沉淀与溶液中含铝元素的物质分别为:Al(OH)3和NaAlO2
依照总反应式:2Al3++7OH-=Al(OH)3↓+AlO2-+2H2O,答案为A
本题难度:一般
5、实验题 取2g干燥铝粉和3g碘粉小心混匀,分为四堆。往各堆上分别加0.5g水,1g明矾,1g胆矾,1g无水硫酸铜。加水那堆首先冒火花,发生剧烈反应,其次发生反应的是加明矾的那一堆,再次是加胆矾的发生反应,而加无水硫酸铜的那一堆最难发生反应。
(1)铝和碘反应的方程式为_________________________;
(2)铝和碘反应还可以看到的现象是_________________________;
(3)四堆混合物发生反应的先后顺序说明:①_________,②____________。
参考答案:(1)2Al+3I2=2AlI3
(2)还可以看到产生紫色蒸气(碘受热升华)
(3)说明:①水作为催化剂,提高铝和碘化合的反应速率;②第一堆反应快,是直接加水的原因,第二堆比第一堆反应快是由于明矾中结晶水易失去,而胆矾中的结晶水相对较难失去(结晶水失去的难易比较)
本题解析:(1)2Al+3I2=2AlI3
(2)还可以看到产生紫色蒸气(碘受热升华)
(3)说明:①水作为催化剂,提高铝和碘化合的反应速率;②第一堆反应快,是直接加水的原因,第二堆比第一堆反应快是由于明矾中结晶水易失去,而胆矾中的结晶水相对较难失去(结晶水失去的难易比较)
本题难度:一般