1、简答题 某化学反应2A?B+D在四种不同条件下进行,B、D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表所示:
实验
序号 | 时间
浓度
温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60
1
800
1.0
0.80
0.67
0.57
0.50
0.50
0.50
2
800
c2
0.60
0.50
0.50
0.50
0.50
0.50
3
800
c3
0.92
0.75
0.63
0.60
0.60
0.60
4
820
1.0
0.40
0.25
0.20
0.20
0.20
0.20
|
根据上述数据,回答下列问题(要有计算过程):
(1)在实验1中,反应在10~20min内反应物A的平均反应速率
(2)在实验4中,反应在0~10min内反应物A的平均反应速率.
参考答案:(1)v(A)=△c△t=0.8mol/L-0.67mol/L10min=0.013mol/(L.min),
故答案为 0.013;
(2)v(A)=△c△t=1.0mol/L-0.4mol/L10min=0.06mol/(L?min),
故答案为:0.06mol/(L?min).
本题解析:
本题难度:一般
2、选择题 某学习小组为了探究?BrO3-+5Br-+6H+=3Br2+3H2O?反应速率(v)与反应物浓度的关系,在20℃进行实验,所得的数据如下表:
实验编号
相关数据 | ① | ② | ③ | ④ | ⑤
c(H+)/mol?L-1
0.008
0.008
0.004
0.008
0.004
c(BrO3-)/mol?L-1
0.001
0.001
0.001
0.002
0.002
c(Br-)/mol?L-1
0.10
0.20
0.20
0.10
0.40
v/mol?L-1?s-1
2.4×10-8
4.8×10-8
1.2×10-8
4.8×10-8
v1
|
下列结论不正确的是( )
A.若温度升高到40℃,则反应速率增大
B.实验②、④,探究的是c(BrO3-)对反应速率的影响
C.若该反应速率方程为v=k?ca(BrO3-)cb(Br-)cc(H+)(k为常数),则c=2
D.实验⑤中,v1=4.8×10-8mol?L-1?s-1
参考答案:A、由于温度升高,反应速率增大,故A正确;
B、实验②、④中,c(Br-)也不相同,故B错误;
C、②、③中,氢离子浓度增大1倍,速率增大到原来的4倍,故c=2,故C正确;
D、③、⑤中,c(Br-)和c(BrO3-)浓度关系,⑤中的二者浓度都比③中的增大一倍,速率增大4倍,v1=4.8×10-8mol?L-1?s-1,故D正确;
故选B.
本题解析:
本题难度:简单
3、选择题 反应4A(s)+3B(g)  2C(g)+D(g),经2 min,B的浓度减少0.6 mol/L,对此反应速率的表示不正确的是(?)
2C(g)+D(g),经2 min,B的浓度减少0.6 mol/L,对此反应速率的表示不正确的是(?)
A.在2 min内的反应速率用B表示为0.3 mol/(L·min)
B.在2 min内用C表示反应速率是0.2 mol/(L·min)
C.v (B)=3v(D)
D.v (A)="0.4" mol/(L·min)
参考答案:D
本题解析:反应速率通常用单位时间内浓度的变化量来表示,所以根据题意可知,B物质的反应速率是0.6mol/L÷2min=0.3 mol/(L·min)。又因为反应速率之比是相应的化学计量数之比,所以A物质的反应速率是0.3 mol/(L·min)÷3=0.1 mol/(L·min),选项D不正确,其余都是正确的,答案选D。
点评:在计算反应速率时,除根据定义式进行计算外,常用的方法是依据化学反应中反应速率之比是相应的化学计量数之比进行有关的计算和判断。
本题难度:一般
4、选择题 在Zn+H2SO4 = ZnSO4+H2?反应中,2分钟内硫酸浓度由l.5 mol·L-1降至1.1 mol·L-1,则2分钟内用硫酸表示的平均反应速率为?(?)
A.0.1mol·L-1·min-1
B.0.2mo1·L-1·min-1
C.0.3mol·L-1·min-1
D.0.4mo1·L-1·min-1
参考答案:B
本题解析:v(H2SO4)= 。答案选B。
。答案选B。
点评:本题非常基础简单,只要根据公式计算即可。
本题难度:一般
5、选择题 对于反应2SO2(g)+O2(g)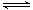 2SO3(g),下列有关说法正确的是(?)
2SO3(g),下列有关说法正确的是(?)
A.通入大量O2,V正增大,V逆减小
B.2V正(SO2) =V逆(O2)时,反应达到平衡
C.恒温恒容充入Ne,容器内压强增大,V正、V逆均不变
D.V (SO2)∶V (O2)∶V (SO3) =2∶1∶2时,反应达到平衡
参考答案:C
本题解析:增大反应物氧气的浓度正反应速率增大,逆反应速率瞬间是不变的,A不正确;B中反应速率的方向相反,但反应速率不能满足相应的化学计量数之比,所以不能说明达到平衡状态,B不正确;平衡时反应速率各种物质的浓度不再发生变化,但各种物质的浓度不一定相等或满足某种关系,D不正确,因此答案选C。
点评:在判断压强对反应速率的影响时,相应注意的是,压强的影响只能适用于气体参加的体系,其次压强改变的实质是通过改变浓度引起的,再就是改变压强一般是通过改变容器容积引起,这就是说即使压强变化了,如果浓度不变,反应速率是不变的。
本题难度:一般