1、选择题 下列实验设计不能达到预期目的是
A.①
B.②
C.③
D.④
参考答案:A
本题解析:分析:A.硫酸钙微溶,覆盖在碳酸钙的表面,影响实验效果;
B.二氧化氮为红棕色气体,利用颜色的变化来分析温度对平衡的影响;
C.原电池中,Fe为负极,发生Fe与Cu2+的反应;
D.H2O2溶液的试管中分别滴入适量的CuSO4溶液和FeCl3溶液,分解速率不同.
解答:A.因硫酸钙微溶,覆盖在碳酸钙的表面,影响实验效果,不能探究接触面积对反应速率的影响,若改为盐酸能实现实验目的,故A错误;
B.二氧化氮为红棕色气体,利用颜色的变化来分析温度对平衡的影响,则可实现探究温度对化学平衡的影响,故B正确;
C.原电池中,Fe为负极,发生Fe与Cu2+的反应,说明铜离子的氧化性大于亚铁离子的氧化性,故C正确;
D.H2O2溶液的试管中分别滴入适量的CuSO4溶液和FeCl3溶液,分解速率不同,可探究不同催化剂对同一反应速率的影响,故D正确;
故选A.
点评:本题考查实验方案的评价,熟悉影响反应速率的因素、氧化性的比较、化学平衡的影响因素等即可解答,题目难度不大.
本题难度:困难
2、选择题 利用下列实验装置能完成相应实验的是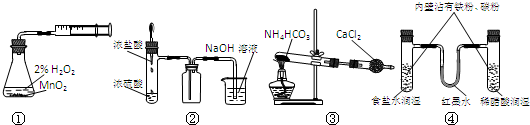
A.装置①测定化学反应速率
B.装置②制取并吸收HCl
C.装置③制备纯净的NH3
D.装置④模拟铁的腐蚀
参考答案:AD
本题解析:分析:A.可根据一定时间内生成气体的体积测定反应速率;
B.导管不能插入液面以下;
C.氨气不能用氯化钙干燥;
D.根据铁的腐蚀类型以及原理分析.
解答:解:A.根据一定时间内生成气体的体积,可测定化学反应速率,故A正确;
B.装置②可制取HCl,但尾气吸收装置不能将导管插入液面以下,会发生倒吸,故B错误;
C.装置③可用碱性干燥剂吸收水和二氧化碳,氯化钙和氨气能发生络合反应,不能用氯化钙干燥,故C错误;
D.在食盐水中铁发生吸氧腐蚀,在醋酸中发生析氢腐蚀,U形管内左端红墨水上升,右端红墨水下降,故D正确.
故选AD.
点评:本题考查化学实验方案的评价,题目难度不大,易错点为C,注意氯化钙作为干燥剂的性质.
本题难度:一般
3、选择题 下列实验设计能够成功的是
A.A
B.B
C.C
D.D
参考答案:BD
本题解析:分析:A、加入硝酸钡生成的亚硫酸钡沉淀加入硝酸会被氧化为硫酸钡;
B、卤代烃在碱溶液中水解,卤素原子变化为卤离子,加入稀硝酸和硝酸银生成白色沉淀;
C、过氧化氢是氧化剂,稀硝酸是氧化剂,都能氧化碘离子;
D、油污在碱性溶液中水解生成溶于水的物质,用蒸馏水洗涤;
解答:A、加入硝酸钡生成的亚硫酸钡沉淀,加入硝酸会被氧化为硫酸钡,不能证明亚硫酸根离子的存在;故A错误;
B、卤代烃在碱溶液中水解,卤素原子变化为卤离子,加入稀硝酸和硝酸银生成白色沉淀,是氯离子的检验方法;故B正确;
C、过氧化氢是氧化剂,稀硝酸是氧化剂,都能氧化碘离子,碘单质遇淀粉变蓝;故C错误;
D、油污在碱性溶液中水解生成溶于水的物质,铁屑用热的碳酸钠溶液洗涤,油污水解生成溶于水的物质,用蒸馏水洗涤除去;故D正确;
故选BD.
点评:本题考查了离子检验实验设计的方案正误判断,离子性质的分析,注意干扰离子的分析判断,题目难度中等.
本题难度:简单
4、填空题 合成氨工业、硫酸工业的生产工艺流程大致为
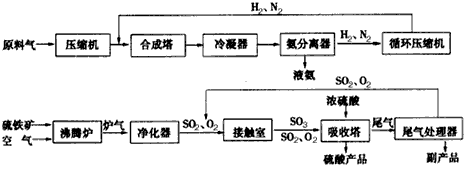
合成塔和接触室中的反应分别为:
N2(g)+3H2(g)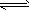 2NH3(g) △H<0 ①
2NH3(g) △H<0 ①
2SO2(g)+O2( g)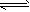 2SO3(g) △H <0 ②
2SO3(g) △H <0 ②
(1)进入合成塔和接触室中的气体都要进行热处理,最理想的热处理方法是____________。
(2)采用循环操作可提高原料的利用率,下列工业生产中,采用循环操作的是_______(填写序号)。
①硫酸工业②合成氨工业③硝酸工业
(3)根据化学平衡移动原理来确定的条件或措施有________(填写序号)。
①合成氨工业在高压下进行
②合成氨工业和硫酸工业都使用催化剂
③合成氨工业和硫酸工业都使用适宜的温度
④硫酸工业中,净化后的炉气中要有过量的空气
⑤及时将氨液化而分离
⑥吸收塔中用98.3%的浓硫酸吸收SO3
⑦硫酸工业的催化氧化在常压下进行
(4)工业生产中常用氨--酸法进行尾气脱硫,以达到消除污染、废物利用的目的。硫酸工业的尾气中含有
SO2,直接排放到空气中会造成环境污染,引起的后果是_____________,处理该尾气可以得到一种化肥,写出该肥料的化学式________。
参考答案:(1)充分利用反应中放出的热量加热反应气
(2)①②③
(3)①③④⑤
(4)形成酸雨;(NH4)2SO4
本题解析:
本题难度:一般
5、填空题 (三选一)【化学—化学与技术】
硫酸是一种重要的化工原料,硫酸工业的“三废”处理之一是对尾气处理,其中一种方法便是用天然海水进行尾气脱硫。
(1)硫酸工业生产的主要设备有_______、________和吸收塔。在吸收塔内装有大量磁环的作用是____________,浓硫酸从塔顶喷下,SO3吸收操作采取_________形式(原理);硫酸工业的尾气主要成分有SO2、O2、N2等。
(2)天然海水主要含有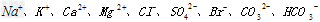 等离子。
等离子。
①天然海水pH约为8,原因是海水中________、_________离子水解所致。
②尾气进入吸收塔内,塔顶喷下大量海水,O2能将?H2SO3、HSO3-?、SO32-?等氧化,试写出其中一个反应的方程式:?________________。
③向氧化后的海水中加入天然海水,其目的是中和、稀释氧化后海水中生成的酸,最终排放出的海水中SO42-浓度与进入吸收塔的天然海水相比,?SO42-浓度________(填序号)。
A.减少 B.增大 C.不变 D.无法判断
参考答案:(1)沸腾炉;转换器(接触室);增大吸收(接触)面积?;?逆流
(2)①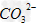 ;HCO3-;②
;HCO3-;②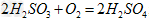
(或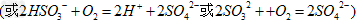 )
)
③B
本题解析:
本题难度:一般