1、选择题 叠氮酸钠(NaN3)是抗禽流感药物“达菲”合成过程中的中间活性物质,3molNaN3受撞击会生成4mol氮气和离子化合物(Na3N).下列有关叙述错误的是( )
A.NaN3受撞击时,既是氧化剂又是还原剂
B.NaN3属于有机化合物
C.Na3N中N3-半径比Na+半径大
D.NaN3中,既存在离子键又存在非极性共价键
参考答案:3molNaN3受撞击会生成4mol氮气和离子化合物(Na3N)的方程式为:3NaN3?撞击?.?4N2↑+Na3N.
A、反应中氮元素的化合价既升高又降低,所以NaN3既是氧化剂又是还原剂,故A正确;
B、有机化合物是含有碳原子的化合物,氮化钠不是有机物,故B错误;
C、N3-和Na+具有相同的核外电子数,质子数越多半径越小,所以半径N3->Na+,故C正确;
D、氮化钠中钠离子和氮离子之间是离子键,氮原子之间是非极性共价键,故D正确.
故选C.
本题解析:
本题难度:简单
2、选择题 下列说法正确的是( )
A.稀H2SO4能导电,所以稀H2SO4是电解质
B.氧化还原反应中有一种元素化合价升高必定有另一种元素化合价降低
C.根据是否有丁达尔效应将分散系分为溶液、胶体和浊液
D.根据交叉分类法MgSO4既是镁盐又是硫酸盐
参考答案:A.稀H2SO4属于混合物,不是电解质,故A错误;
B.氧化还原反应可为同种元素之间得失电子,如Cl2+H2O=HCl+HClO,故B错误;
C.分散质离子的大小将分散系分为溶液、胶体和浊液,胶体粒子直径在1~100nm之间,溶液溶质的粒子小于1nm,浊液大于100nm,故C错误;
D.硫酸镁属于盐,含有镁元素,则属于镁盐,含有硫酸根离子,属于硫酸盐,故D正确.
故选D.
本题解析:
本题难度:一般
3、简答题 氧化还原反应是从______的角度对化学反应进行分类的结果.四种基本反应类型是从______的角度对化学反应进行分类的结果.这二者的关系如下图:图中方框内区域表示所有的化学反应,大圈内区域表示氧化还原反应,大圈外区域表示非氧化还原反应,其中A~D分别表示四种基本反应类型.请分别填写出:
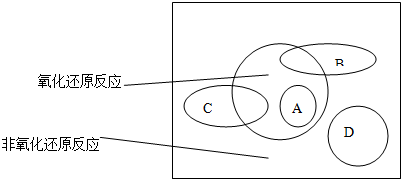
(1)化学反应可以分为哪四种基本类型______、______、______、______.
(2)若图中B圈表示化合反应,则C圈表示______反应(填反应所属的基本类型,下同),A圈表示______反应,D圈表示______反应.
(3)B圈与氧化还原反应重叠的阴影部分表示的反应,必须满足的条件是______.C圈与氧化还原反应重叠的阴影部分表示的反应,必须满足的条件是______.请分别举出符合以上两种情况的一例:______,______.
(4)下列说法正确的是______.
A.置换反应一定属于氧化还原反应
B.有单质参加和有单质生成的化学反应一定是氧化还原反应
C.属于氧化还原反应的化合反应必定是因为有单质参与了反应
D.氧化还原反应发生的本质是化合价发生了变化.
参考答案:分类标准不一样,化学反应的分类结果就不一样,根据化合价是否发生变化,可以将化学反应分为氧化还原反应和非氧化还原反应;根据反应物、生成物的种类及其变化,可以将化学反应分为:化合反应、分解反应、置换反应、复分解反应,故答案为:化合价是否发生变化;反应物、生成物的种类及其变化;
(1)根据反应物、生成物的种类及其变化,可以将化学反应分为:化合反应、分解反应、置换反应、复分解反应,故答案为:化合反应;分解反应;置换反应;复分解反应;
(2)部分化合反应属于氧化还原反应,部分分解反应属于氧化还原反应,所有的置换反应均是氧化还原反应,所有的复分解反应均不是氧化还原反应,故答案为:分解;置换;复分解;
(3)B、C圈表示的反应部分是氧化还原反应,所以是化合反应和分解反应两种情况,故答案为:有元素化合价变化的化合反应;有元素化合价变化的分解反应;4Na+O2=2Na2O;?2KClO3??△?.??2KCl+3O2↑;
(4)A、置换反应一定是氧化还原反应,故A正确;
B、有单质参加和有单质生成的化学反应如3O2═3O3,不属于氧化还原反应,故B错误;
C、属于氧化还原反应的化合反应不一定均有单质参与了反应,比如SO2+H2O2=H2SO4,故C错误;
D、氧化还原反应发生的本质是电子的转移,故D错误.
故选A.
本题解析:
本题难度:一般
4、选择题 下列化学反应中,既属于离子反应又属于氧化还原反应的是( )
A.氢气在氧气中燃烧
B.锌粒与稀硫酸
C.硝酸银溶液与氯化钠溶液
D.红热木炭跟水蒸气反应
参考答案:A.没有离子参加,不属于离子反应,故A不选;
B.有离子参加,也有元素化合价变化,则该反应既属于离子反应又属于氧化还原反应,故B选;
C.没有元素的化合价变化,不属于氧化还原反应,故C不选;
D.没有离子参加,则不属于离子反应,故D不选;
故选B.
本题解析:
本题难度:简单
5、简答题 已知下列两个反应:①Fe+H2SO4(稀)═FeSO4+H2↑;②Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O.试回答下列问题:
(1)反应①中______元素被还原,反应②中______元素被还原.(填元素符号)
(2)当反应①生成2g?H2时,消耗H2SO4的质量是______.
(3)反应②中生成32g?SO2气体时,消耗H2SO4的质量是______?g,其中有______?g?H2SO4作为氧化剂被还原.
参考答案:(1)反应①中化合价降低的H元素被还原,反应②中化合价降低的S元素被还原,故答案为:H,S;
(2)根据化学反应①可知,当反应①生成2gH2时,消耗H2SO4的质量是98g,故答案为:98g;
(3)根据化学反应②可知,反应②中生成64gSO2气体时,消耗H2SO4的质量是196g,在这部分硫酸中,只有一半做氧化剂,被还原,所以生成32gSO2气体时,消耗H2SO4的质量是98g,其中只有49g被还原,故答案为:98,49.
本题解析:
本题难度:一般