|
|
|
高中化学知识点总结《化学反应与能量》高频考点预测(2019年最新版)(六)
2020-08-13 05:39:58
【 大 中 小】
|
1、选择题 25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是( )
A.2H2(g)+O2(g) ="=" 2H2O(1)△H=
|
参考答案:
本题解析:
本题难度:一般
2、选择题 用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术.已知反应:Fe2O3+3Na2O2 2Na2FeO4+Na2O,下列说法正确的是 2Na2FeO4+Na2O,下列说法正确的是
A.Na2O2既是氧化剂又是还原剂
B.在Na2FeO4中Fe为+4价,具有强氧化性.能消毒杀菌
C.3?mol?Na2O2发生反应,有12?mol电子转移
D.Na2FeO4既是氧化产物又是还原产物
参考答案:D
本题解析:分析:依据化学反应Fe2O3+3Na2O2 2Na2FeO4+Na2O,分析判断 2Na2FeO4+Na2O,分析判断
A、标注化合价升高的为还原剂,降低的为氧化剂;
B、铁元素为正六价;
C、根据氧化还原反应的电子守恒计算;
D、依据化合价的变化判断概念;
解答:A、反应中过氧化钠中 氧元素化合价选-1价降低到-2价,做氧化剂,故A错误;
B、在Na2FeO4中Fe为+6价,故B错误;
C、3?mol?Na2O2发生反应,有6?mol电子转移,故C错误;
D、Na2FeO4中的铁元素是从+3价变化来的成为+6价,氧元素化合价从-1价变化成-2价,所以Na2FeO4既是氧化产物又是还原产物,故D正确;
故选D.
点评:本题考查了氧化还原反应的应用,主要考查氧化还原反应的特征应用,概念分析,电子转移计算,氧化产物和还原产物的分析判断.
本题难度:简单
3、填空题 在一个密闭容器中,发生下列反应:C(s)+H2O(g) 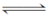 CO(g)+H2(g) ΔH>0,达到平衡后,试回答下列问题 CO(g)+H2(g) ΔH>0,达到平衡后,试回答下列问题
(1)上述正向反应是:?反应(填:放热、吸热)。
(2)该反应的化学平衡常数表达式为K=?。
(3)恒温恒容通人H2O(g),原化学平衡向?反应方向移动(填“正移”、“逆移”“不移”下同)c(CO)____(填“增大”、“减小”或“不变” 下同)。
(4)减小密闭容器的容积,保持温度不变,原化学平衡向?反应方向移动,v(正) ?。
(5)某温度下上述反应平衡时,恒容、降低温度,原化学平衡向?反应方向移动,容器内混合气体的压强?。
参考答案:(1)?吸热?。?(2)K= Cco·CH2/CH2O?。
(3) ?正?,?增大? (4) ?逆?,?增大?。(5)?逆 ?, ?减小
本题解析:(1)根据反应的热化学方程式可知,上述正向反应是吸热反应。
(2)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,则根据方程式可知,平衡常数K=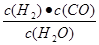 . .
(3)恒温恒容通人H2O(g),相当于是增大反应物浓度,则原化学平衡向正反应方向移动,c(CO)增大。
(4)减小密闭容器的容积,保持温度不变,相当于是增大压强,原化学平衡向逆反应方向移动,v(正)增大。
(5)某温度下上述反应平衡时,恒容、降低温度,原化学平衡向逆反应方向移动,容器内混合气体的压强减小。
点评:该题是高考中的常见题型,属于基础性试题的考查。试题基础性强,侧重对学生基础知识的巩固和训练,有利于培养学生的逻辑推理能力和发散思维能力,提高学生灵活运用基础性知识解决实际问题的能力。
本题难度:一般
4、选择题 化学反应N2+3H2 2NH3的能量变化如下图所示,该反应的热化学方程式是 2NH3的能量变化如下图所示,该反应的热化学方程式是
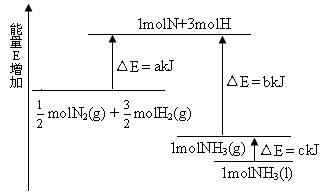
A.N2(g)+3H2(g)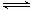 2NH3(1) △H=2(a-b-c)kJ·mol-1 2NH3(1) △H=2(a-b-c)kJ·mol-1
B.N2(g)+3H2(g)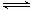 2NH3(g) △H=2(b-a)kJ·mol-1 2NH3(g) △H=2(b-a)kJ·mol-1
C.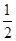 N2(g)+ N2(g)+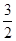 H2(g) H2(g) 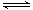 NH3(1) △H=(b+c-a)kJ·mol-1 NH3(1) △H=(b+c-a)kJ·mol-1
D.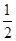 N2(g)+ N2(g)+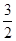 H2(g) H2(g)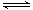 NH3(g) △H=(a+b)kJ·mol-1 NH3(g) △H=(a+b)kJ·mol-1
|
参考答案:A
本题解析:
本题较新,也很有特色;重在看清图中标识,找准分子,原子变化过程中相应的能量变化。
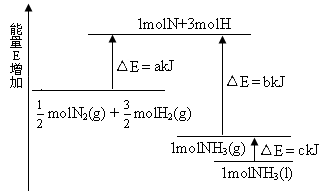
图中a 为反应物键能之和;
图中b 为生成物键能之和;
图中c 为1 mol NH3液化时放出的能量。
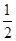 N2(g)+
N2(g)+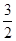 H2(g)
H2(g)  NH3(1) △H=(a-b-c)kJ·mol-1各项同时乘2得
NH3(1) △H=(a-b-c)kJ·mol-1各项同时乘2得
N2(g)+3H2(g)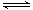 2NH3(1) △H=2(a-b-c)kJ·mol-1
2NH3(1) △H=2(a-b-c)kJ·mol-1
本题难度:一般
5、选择题 下列各组中的物质或离子都含配位键的是(?)
A.H2O、Al2Cl6
B.CO2、SO42-
C.PCl5、[Co(NH3)4Cl2]Cl
D.NH4Cl、[Cu(NH3)4]SO4
参考答案:D
本题解析:形成配位键的条件是必须有提供孤对电子的配体和接受孤对电子的空轨道。所以只有选项D 是正确的,答案选D。
本题难度:一般

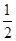 N2(g)+
N2(g)+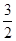 H2(g)
H2(g) 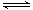 NH3(1) △H=(a-b-c)kJ·mol-1各项同时乘2得
NH3(1) △H=(a-b-c)kJ·mol-1各项同时乘2得 2NH3(1) △H=2(a-b-c)kJ·mol-1
2NH3(1) △H=2(a-b-c)kJ·mol-1