1、简答题 下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族
周期 | IA | | 0
1
①
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
2
②
③
④
3
⑤
⑥
⑦
⑧
|
(1)④、⑤、⑥的原子半径由大到小的顺序为______(用元素符号表示).
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是______.
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的化合物,写出其中一种化合物的电子式:______.
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)______.
a.MnO2 b.AlCl3 c.Na2SO3? d.KMnO4
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
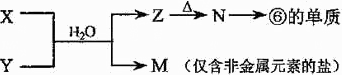
X溶液与Y溶液反应的离子方程式为______,N→⑥的单质的化学方程式为______.
(6)已知破坏1mol?N≡N键、H-H键、N-H键分别需要吸收的能量为946kJ、436kJ、391kJ.则1molN2完全反应转化为NH3共______(填“吸收”或“放出”)能量______?kJ.
参考答案:根据元素在周期表中的位置可判断元素的种类,①为H元素,②为C元素,③为N元素,④为O元素,⑤为Na元素,⑥为Al元素,⑦为Si元素,⑧为Cl元素.
(1)电子层越多半径越大,所以O半径最小,同周期元素原子半径从左到右逐渐减小,即Na>Al,故答案为:Na>Al>O;
(2)元素周期表中,同周期从左到右元素的非金属性逐渐增强,同主族从上到下元素的非金属性逐渐减弱,则非金属性的强弱顺序为N>C>Si,非金属性越强,对应最高价氧化物的水化物的酸性越强,故有酸性HNO3>H2CO3>H2SiO3,故答案为:HNO3>H2CO3>H2SiO3;
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物有NaOH、NaClO、NaClO3等物质,属于离子化合物,故答案为:
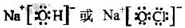
;
(4)过氧化氢在MnO2、FeCl3等做催化剂的条件下易发生分解生成氧气,而Na2SO3具有还原性,与过氧化氢反应生成钠硫酸,高锰酸钾具有氧化性,氧化过氧化氢生成氧气,不能用来做催化剂,氯化铝对水的分解无影响,不能作催化剂,故答案为:a;
(5)由
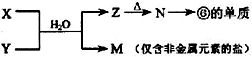
反应转化可知,⑥为Al元素,则N为Al2O3,Z为Al(OH)3,M为仅含非金属元素的盐,应为铵盐,则反应X+Y应是氨气和铝盐在水溶液中的反应,X溶液与Y溶液反应的离子方程式为Al3++3NH3?H2O=Al(OH)3↓+3NH4+;工业冶炼铝用电解氧化铝的方法,反应方程式为2Al2O3(熔融) ?电解?.冰晶石4Al+3O2↑,
故答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;2Al2O3(熔融) ?电解?.冰晶石4Al+3O2↑;
(6)反应热=吸收的总能量-放出的总能量,所以1mol?N2生成NH3的反应热=946kJ+3×436 kJ-2×3×391kJ=-92kJ,所以是放出热量,故答案为:放出;92.
本题解析:
本题难度:一般
2、简答题 下面是元素周期表的简略框架图.
回答下列问题:
(1)元素a在元素周期表中的位置是______,元素i的原子核外最外层电子数为______,元素f和h形成化合物的电子式是______.
(2)元素c和g中,非金属性较强的是______(填元素符号),支撑这一结论的化学事实是______.
(3)写出由cd2转化为cd的化学方程式:______;b、d、e形成的一种盐俗称纯碱,其中常混有其对应的酸式盐,用化学方程式表示除去该酸式盐的方法:______.
参考答案:(1)由元素在周期表中的位置可知,a为氢,i为氩,f为镁,h为氯,则氢元素在第一周期、ⅠA族,氩的质子数为
18,其最外层电子数为8,Mg与Cl形成化合物时镁失去最外层2个电子成为金属阳离子,氯原子得到1个电子成为氯离子,氯化镁的电子式为
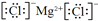
,故答案为:第一周期、ⅠA族;8;
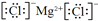
;?
(2)c为氮,g为磷,同主族元素随原子序数的增大,非金属性减弱,则N元素的非金属性强,可由HNO3的酸性比H3PO4强或NH3的热稳定性比PH3强等来说明非金属性N>P,故答案为:N;HNO3的酸性比H3PO4强或NH3的热稳定性比PH3强等;?
(3)d为氧,则cd2转化为cd,即NO2转化为NO,转化的反应为3NO2+H2O═2HNO3+NO,纯碱中常混有其对应的酸式盐为
NaHCO3,其受热容易分解生成碳酸钠,从而达到除杂的目的,其反应为2NaHCO3?△?.?Na2CO3+H2O+CO2↑,
故答案为:3NO2+H2O═2HNO3+NO;2NaHCO3?△?.?Na2CO3+H2O+CO2↑.
本题解析:
本题难度:一般
3、选择题 有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,?Z、M同主族;?X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中,正确的是?
[? ]
A.X、M两种元素只能形成X2M型化合物
B.由于W、Z、M元素的氢气化物相对分子质量依次减小,所以其沸点依次降低
C.元素W和M的某些单质可作为水处理中的消毒剂
D.元素Y、Z、W的单质晶体属于同种类型的晶体
参考答案:C
本题解析:
本题难度:一般
4、选择题 下列各组按原子半径增大的顺序排列的是
A.Na、Mg、Al
B.N、P、Cl
C.Li、Na、K
D.I、Cl、F
参考答案:C
本题解析:
本题难度:一般
5、填空题 X、Y、Z是IA→ⅦA族的三种非金属元素,它们在周期表中的位置如下表所示

试回答:
(1)X元素单质的化学式是________________。
(2)Y元素的原子结构示意图是_______,Y与Na 所形成化合物的电子式为____________。
(3)Z元素的名称是________,从元素原子得失电子的角度看,Z元素具有_______性;若从Z元素在周期表中所处位置看,它具有这种性质的原因是______________,其价电子排布式为_______。
参考答案:(1)F2
(2)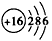 ;
;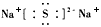
(3)砷;两;Z位于元素周期表中金属与非金属交界线附近;4s24p3
本题解析:
本题难度:一般