|
|
|
高考化学知识点总结《盐类水解的原理》试题预测(2019年最新版)(五)
2020-08-13 05:43:04
【 大 中 小】
|
1、选择题 下列说法错误的是
A.常温下,若醋酸钠与醋酸的混合溶液pH=7,则C(Na+)=c(CH3COO-)
B.某温度下,pH=6的NaCl溶液中离子浓度的大小关系:c(Na+)= c(Cl-)>c(H+)>c(OH-)
C.若2a mol·L-1HCN与a mol·L-1 NaOH溶液等体积混合后所得溶液中c(Na+)>c(CN-),则混合溶液pH>7
D.含0.1 mol NaHCO3和0.2molNa2CO3的混合液中:c(Na+)+c(H+)=c(OH-)+c(HCO3—)+2c(CO32—)
|
2、选择题 下列物质中,水解的最终产物不能发生银镜反应的是( ? )
A.蔗糖
B.油脂
C.纤维素
D.淀粉
3、选择题 下列说法正确的是
A.酸式盐的水溶液一定显碱性
B.醋酸铵溶液呈中性是因为溶液中H+的物质的量和OH-的物质的量相等
C.NaHSO3溶液的PH大于Na2SO4溶液的PH
D.只要酸与碱的物质的量浓度和体积分别相等,它们反应后的溶液就呈中性
|
4、填空题 某探究小组将一批电子废弃物简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计如下制备硫酸铜晶体和无水氯化铁的方案:
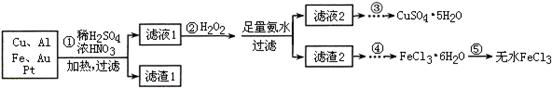
已知:Cu2+ + 4NH3·H2O=[Cu(NH3)4]2+ + 4H2O
请回答下列问题:
(1)步骤①Cu与酸反应的离子方程式为 。
(2)步骤②加H2O2的作用是 ,滤渣2为(填化学式) 。
(3)步骤⑤不能直接加热脱水的理由是 。
(4)若滤液1中Cu2+的浓度为0.02mol·L-1,则氢氧化铜开始沉淀时的pH =
(已知:Ksp[Cu(OH)2]=2.0×10-20)。
(5)已知:2Cu2++4I-= 2CuI↓+I2 I2+2S2O32-= 2I-+S4O62-
某同学为了测定CuSO4·5H2O产品的质量分数可按如下方法:取3.00g产品,用水溶解后,加入足量的KI溶液,充分反应后过滤、洗涤,将滤液稀释至250mL,取50mL加入淀粉溶液作指示剂,用0.080 mol·L-1 Na2S2O3标准溶液滴定,达到滴定终点的依据是 。
四次平行实验耗去Na2S2O3标准溶液数据如下:
实验序号
| 1
| 2
| 3
| 4
|
消耗Na2S2O3标准溶液(mL)
| 25.00
| 25.02
| 26.20
| 24.98
|
此产品中CuSO4·5H2O的质量分数为
。
5、选择题 在配置Fe2(SO4)3溶液时,为了防止水解,常常往溶液中加入少量的:( )
A.NaOH
B.H2SO4
C.KCl
D.CH3COOH
