1、选择题 已知七种短周期元素a~g的有关信息如下表所示:
元素编号
| a
| b
| c
| d
| e
| f
| g
|
原子半径/nm
| 0.037
| 0.074
| 0.082
| 0.102
| 0.143
| 0.152
| 0.186
|
最高化合价或最低化合价
| +1
| -2
| +3
| -2
| +3
| +1
| +1
|
下列推断不正确的是
A.氢化物稳定性的强弱:b>d? B.金属性的强弱:f<g
C.元素e的氧化物只能与酸反应? D.元素a与元素d形成的化合物属于共价化合物
参考答案:C
本题解析:分析表中数据得:a为H元素,f为Na元素,g为K元素,b为O元素,d为S元素,c为Be元素,e为Al元素。
C、元素e为Al元素,既可以与酸反应也可以与碱反应,故错。故选C。
点评:本题考查元素位置结构和性质的关系及应用,题目难度中等,从原子半径的变化和元素的最高正价和最低负价入手寻求突破,正确把握元素化合价、原子半径与元素性质的关系是解答该题的关键。
本题难度:简单
2、选择题 下列各指定原子序数的元素,不能形成AB2型化合物的是
A.6和8
B.16和12
C.12和9
D.16和8
参考答案:B
本题解析:形成AB2化合物,设B为-1价,A为+2价;B为-2价,A为+4价。结合原子序数推知,形成物质分别为A、CO2,C、MgF2,D、SO2
本题难度:简单
3、选择题 下列结构示意图所代表的微粒属于阴离子的是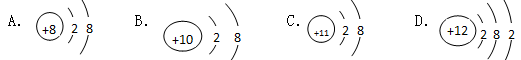
参考答案:A
本题解析:核外电子数大于质子数即为阴离子,符合条件的只有A,BD是原子,C 是阳离子,故选A
本题难度:简单
4、选择题 下列数据是对应物质的熔点据此做出的下列判断中错误的是?
Na2O
| NaCl
| AlF3
| AlCl3
|
920
| 801
| 1291
| 190
|
BCl3
| Al2O3
| CO2
| SiO2
|
-107
| 2073
| -57
| 1723
|
?
A.铝的化合物的晶体中有的是离子晶体?
B.表中只有BCl3和干冰是分子晶体
C.同族元素的氧化物可形成不同类型的晶体
D.不同族元素的氧化物可形成相同类型的晶体
参考答案:B
本题解析:A. AlF3、Al2O3是离子晶体;AlCl3是分子晶体。正确。B.在表中AlCl3、BCl3和干冰都是分子晶体。错误。CO2是分子晶体,SiO2是原子晶体。同族元素的氧化物可形成不同类型的晶体。正确。D.Na、Al是不同族元素,但是Na2O、Al2O3都是离子晶体,是相同类型的晶体。正确。
本题难度:一般
5、选择题 关于等物质的量的12C和14C的叙述中正确的是
①含有相同数目的原子;②含有相同物质的量的质子;③属于同种元素;④具有相同的质量;⑤中子数相等;⑥电子数相等;⑦与氧气完全反应生成CO2时,消耗氧气的量相同;⑧几乎相同的化学性质;
A.只有②③⑤
B.只有①②③
C.除④、⑤外均正确
D.全部正确
参考答案:C
本题解析:12C和14C互为同位素所以:①正确;含有相同数目的原子;②正确;含有相同物质的量的质子;③正确;属于同种元素;④错,12C和14C的质量数分别为12和14,质量数不同;⑤错,12C和14C的中子数分别为8和8;⑥正确;电子数相等;⑦正确;与氧气完全反应生成CO2时,消耗氧气的量相同;⑧正确;几乎相同的化学性质
本题难度:简单