1、填空题 (2分)甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和
液态水,已知室温下1g甲硅烷自燃放出热量44.6 kJ,其热化学方程式是:
?。
参考答案:SiO2(g)+2O2(g)=SiO2(s)+2H2O(l);ΔH=-1427.2KJ/mol(2分)
本题解析:略
本题难度:简单
2、填空题 (6分)如图所示,在一个小烧杯里加入研细的20g Ba(OH)2·8H2O晶体。将此小烧杯放在事先滴有3~4滴水的玻璃片上,然后向小烧杯中加入10g NH4Cl晶体,并用玻璃棒快速搅拌。
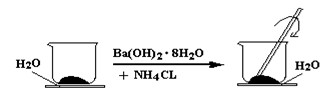
 (1)实验中要用玻璃棒搅拌的原因是?
(1)实验中要用玻璃棒搅拌的原因是?
 ?(2)写出有关反应的化学方程式:?,
?(2)写出有关反应的化学方程式:?,
该反应?(填“是”或“不是”)氧化还原反应。&s.5*u.c.#om
(3)该实验中观察到的现象除产生刺激性气味的气体及反应混合物呈糊状以外,还有
 ?。
?。
(4)通过最后一个现象可以说明该反应为_________(填“吸”或“放”)热反应,这是由于反应物的总能量_________(填“大于”或“小于”)生成物的总能量。
参考答案:
(1)该反应是固体之间的反应,搅拌可使混合物充分接触并发生反应
(2) Ba(OH)2·8H2O +2NH4Cl = BaCl2 +2NH3↑ +10 H2O?不是
(3) 玻璃片上因结冰而与小烧杯粘在一起
(4) 吸,小于
本题解析:略
本题难度:简单
3、简答题 (1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是非通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是______(填“吸热”或“放热”)反应,NO2和CO的总能量______(填“>”、“<”或“=”)CO2和NO的总能量.
(2)在某体积为2L的密闭容器中充入1.5mol?NO2和2mol?CO,在一定条件下发生反应:NO2+CO═CO2+NO,2min时,测得容器中NO的物质的量为0.5mol,则:
①该段时间内,用CO2表示的平均反应速率为______;12min时,容器内气体的总物质的量为______.
③假设此反应在5min时达到平衡,则此时容器内气体的总物质的量______(填“大于”、“小于”或“等于”)2min时容器内气体的总物质的量.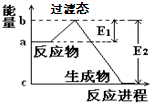
参考答案:(1)根据图象知:反应物的总能量大于生成物的总能量,根据能量守恒定律得,该反应是放热反应;NO2和CO是反应物,CO2和NO是生成物,所以NO2和CO的总能量>CO2和NO的总能量,故答案为:放热;>;
(2)①NO2 +CO═CO2 +NO
反应开始1.5mol? 2mol? 0? 0
2min时?1mol?1.5mol?0.5mol? 0.5 mol
CO2的平均反应速率=△nV△t=?0.5mol?2L2min=0.125mol/Lmin,
因为反应前后气体的计量数之和不变,所以反应前后气体的物质的量之和不变,故容器内气体的总物质的量为3.5mol;
故答案为:0.125mol/Lmin;3.5mol;
③因为反应前后气体的计量数之和不变,所以反应前后气体的物质的量之和不变,故容器内气体的总物质的量5min时和2min时一样,故答案为:等于.
本题解析:
本题难度:一般
4、填空题 (12分)
(1)在250C、101KPa时,1g甲醇完全燃烧生成CO2和液态水时放热22.68kJ,则能表示甲醇燃烧的热化学方程式为:
________________________________________________________________________。
(2)已知:C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)="==" CO2(g);?△H=—394kJ·mol—1;
2CO(g)+O2(g)="==" 2CO2(g);?△H=—566kJ·mol—1;
2H2(g)+O2(g)="==" 2H2O(g);?△H=—484 kJ·mol—1;
①在25℃、101KPa时,1 g甲醇不完全燃烧生成1∶1的CO、CO2和液态水,写出此甲醇燃烧的热化学方程式:
_____________________________________________________________________。
②工业上可由CO和H2合成甲醇。试写出由C(s)与水蒸气在高温条件下反应生成氢气
和一氧化碳的热化学方程式?。
(3)利用甲醇可设计燃料电池。
①如用氢氧化钾溶液做电解质溶液,用多孔石墨做电极,在电极上分别充入甲醇和氧
气。写出负极的电极反应式?。
②下列有关甲醇燃料电池的说法中,错误的是_________
A.甲醇燃料电池的负极发生氧化反应
B.甲醇燃料电池的电子由负极、经外电路流入正极
C.甲醇燃料电池在负极区产生CO
D.甲醇燃 料电池中使用的氢氧化钾浓度保持不变
料电池中使用的氢氧化钾浓度保持不变
参考答案:
(1)CH3OH(g)+3/2O2(g) ===CO2(g)+2H2O(l),△H=—729.6kJ·mol—1
(2)①2CH3OH(g)+5/2O2(g) ===CO (g)+CO2(g)+4H2O(l),△H=—1168.52kJ·mol—1
(g)+CO2(g)+4H2O(l),△H=—1168.52kJ·mol—1
②C(s)+H2O(g) ="==" CO(g)+H2(g),△H=+131 kJ?mol—1
(本小题各3分,建议方程式1分,反应热2分)
(3)①CH3OH+8OH— ="==" CO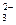 +6H2O+6e
+6H2O+6e
② D
本题解析:略
本题难度:简单
5、选择题 如图,对A生成C的反应,下列所得结论正确的
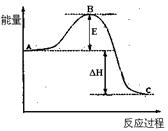
A.该反应进行时,一定有能量放出
B.该反应为吸热反应
C.A物质比C物质稳定
D.该反应肯定很容易,不需要加热就可以进行
参考答案:A
本题解析:根据图像可知,反应物的总能量高于生成物的总能量,所以是放热反应,A正确,B不正确。因为能量越低,物质越稳定,C不正确。反应是否容易发生,和反应是放热反应或吸热反应无关。答案选A。
本题难度:简单