1、选择题 几种短周期元素的原子半径和主要化合价见下表,下列有关说法中,正确的是(?)
元素符号
| X
| Y
| Z
| L
| M
| Q
|
原子半径/nm
| 0.160
| 0.143
| 0.102
| 0.099
| 0.077
| 0.066
|
主要化合价
| +2
| +3
| +6、-2
| +7、﹣1
| +4、﹣4
| -2
|
A.离子半径大小:r(X2+)>r(Q2—)
? B.Y与Q形成的化合物不能跟氢氧化钠溶液反应
? C.Z的单质可在氧气中燃烧生成ZO3
? D.M元素与L元素形成的一种化合物是常见的有机溶剂
参考答案:D
本题解析:考查元素周期律的应用。根据元素原子的半径和主要化合价可判断,X是Mg,Y是Al,Z是S,L是Cl,M是C,Q是O。核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,A不正确。氧化物是两性氧化物,能溶于氢氧化钠溶液中,B不正确。硫燃烧的生成物只能是SO2,而不是三氧化硫,C不正确。四氯化碳是常用的一种有机溶剂,D正确。答案选D。
本题难度:一般
2、选择题 下列关于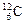 、
、 、
、 的说法正确的是(?)
的说法正确的是(?)
A.它们的化学性质相似
B.它们是碳元素的三种同位素
C.它们是碳元素的三种单质
D.它们是碳元素的同素异形体
参考答案:B
本题解析:略
本题难度:简单
3、填空题 (15分)下表是元素周期表的一部分,用元素符号或化学式回答下列问题:
主族周期
| IA
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
| 0
|
1
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ①
|
2
| ?
| ?
| ?
| ?
| ②
| ③
| ④
| ?
|
3
| ⑤
| ⑥
| ⑦
| ?
| ⑧
| ⑨
| ⑩
| ?
|
(1)在这些元素中_______是最活泼的金属元素;其氢氧化物具有两性的元素是?
(2)这些元素的最高价氧化物对应的水化物中酸性最强的物质的化学式_________
(3)从⑤到⑩元素中_______原子半径最小。
(4)最不活泼的元素的单质的化学式是?。若该元素某核素原子核内中子数与质子数相等,则该核素的摩尔质量是?
(5)用电子式表示⑩、⑥两元素形成化合物的过程
(6)与元素⑨非金属性强弱最接近的元素是?
(7)根据下表判断:最接近磷原子半径R(10-10m)的取值范围的是?
元?素
| N
| S
| O
| Si
|
原子半径/10-10m
| 0.75
| 1.02
| 0.74
| 1.17
参考答案:

本题解析:略
本题难度:一般
4、填空题 (1)某元素原子的价电子构型为3s23p3,它属于第?族,最高正化合价为?,元素名称是?。
(2)某元素原子的价电子构型为3d104s2,它属于第?族,?区元素,元素符号是 ?。
参考答案:(6 分)⑴ ⅤA ,+5,?磷?⑵ ⅡB,? ds,? Zn
本题解析:(1)如果某元素原子的价电子构型为3s23p3,它属于第ⅤA族,最高正化合价为+5价,元素名称是磷。
(2)某元素原子的价电子构型为3d104s2,它属于第ⅡB族。区的名称来自于按照构造原理最后填入电子的轨道名称,据此可知,该元素是ds区元素,元素符号是Zn。
点评:该题是高考中的常见考点,属于基础性试题的考查。试题基础性强,侧重对学生基础知识的巩固和训练,有利于培养学生的逻辑推理能力和应试能力,提高学生灵活运用基础知识解决实际问题的能力。
本题难度:一般
5、填空题 已知A、B、C、D、E五种短周期元素,A的最外层电子数是其电子层数的3 倍,A、B同主族,C在短周期主族元素中原子半径最大,E2是黄绿色气体,D为金属元素,其单质可以用于工业冶炼Fe。
(1)D在周期表中的位置是______?;
A、B、C离子半径由大到小的顺序为______?。(用离子符号回答)
(2)工业上用E的单质制备漂白粉的化学方程式为
_____?_____?;
将少量C2A2加入水中可观察到的实验现象是??;向所得溶液中加入酚酞可观察到溶液先变红后褪色,由此说明溶液中有______?(填化学式)两种物质生成。
(3)D与Fe2O3的反应还可以用于定向爆破,其化学反应方程式为
__?___?;
该反应为______(填“吸热”或“放热”)反应。
(4)常温下,将0.0025 mol的BA2E2溶于水配成0.1L溶液,所得溶液的pH= 1,则 BA2E2与水反应的化学方程式为_______?_____。
参考答案:(1)第三周期第ⅢA族;S2->O2->Na+;
(2)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;浅黄色固体溶解,有无色无味的气体产生;NaOH、H2O2;
(3)2Al+Fe2O3 2Fe+Al2O3;放热; 2Fe+Al2O3;放热;
(4)SO2Cl2+2H2O=H2SO4+2HCl;
本题解析:A、B、C、D、E五种短周期元素,A的最外层电子数是其电子层数的3倍,则A有2个电子层,最外层电子数为6,故A为氧元素,A、B同主族,则B为硫元素;C在短周期主族元素中原子半径最大,则C为Na元素;E2是黄绿色气体,为氯气,则E为Cl元素,D为金属元素,其单质可以用于工业冶炼Fe,则D为Al元素,
(1)D为Al元素,原子核外有3个电子层,最外层电子数为3,在周期表中的位置是第三周期第ⅢA族,电子层结构相同核电荷数越大离子半径越小,最外层电子数相同电子层越多离子半径越大,故离子半径S2->O2->Na+;
(2)工业上用Cl2制备漂白粉的化学方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,将少量Na2O2加入水中,过氧化钠与水反应生成氢氧化钠与氧气,可观察到的实验现象是:淡黄色固体溶解,有无色无味的气体生成,向所得溶液中加入酚酞可观察到溶液先变红后褪色,说明有碱及强氧化性物质生成,应是NaOH、H2O2;
(3)Al与Fe2O3的反应用于定向爆破,反应方程式为Al+Fe2O3 Fe+Al2O3; Fe+Al2O3;
(4)常温下,将0.0025mol的SO2Cl2溶于水配成0.1L溶液,所得溶液的pH=1,SO2Cl2水解应生成H2SO4、HCl,则SO2Cl2与水反应的化学方程式为:SO2Cl2+2H2O=H2SO4+2HCl。
本题难度:一般
|