1、选择题 A、B都是短周期元素,原子半径B>A,它们可形成化合物AB2,由此可以得出的正确判断是(? )
A. 原子序数:A>B? B.A和B可能在同一主族
C. A可能在第2周期ⅣA族? D.A肯定是金属元素
参考答案:C
本题解析:A错,原子序数:B>A;B错,A和B不可能在同一主族;C正确,A可能在第2周期ⅣA族,如CS2;D错,A不一定是金属元素;
本题难度:一般
2、选择题 某元素M的单质1.8g在过量的O2中充分燃烧,得到M2O33.4g,已知M原子核外电子数比核内中子数少1。该元素在周期表中的位置是(?)
A.第2周期ⅢA族
B.第2周期ⅥA族
C.第3周期ⅤA族
D.第3周期ⅢA族
参考答案:D
本题解析:根据氧化物的化学式可知,M的化合价是+3价。根据质量守恒定律可知,消耗乙炔是3.4g-1.8g=1.6g,转移电子是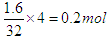 。所以金属的相对原子质量是1.8×3÷0.2=27。又因为M原子核外电子数比核内中子数少1,所以质子数是13,即是铝元素。答案选D。
。所以金属的相对原子质量是1.8×3÷0.2=27。又因为M原子核外电子数比核内中子数少1,所以质子数是13,即是铝元素。答案选D。
本题难度:一般
3、选择题 下列说法中正确的是(?)
A.处于最低能量的原子叫做基态原子
B.在同一能级上运动的电子,其运动状态有可能完全相同
C.电子的运动与行 星相似,围绕原子核在固定的轨道上高速旋转
D.同一原子中,1s、2s、3s电子的能量逐渐增加,2p、3p、4p能级的轨道数依次增多
参考答案:A
本题解析:A 在同一能级上运动的电子,如果自选状态相同,则一定处在不同的轨道(如2Px、2Py、2Pz),如果处在同一轨道,则一定自选状态相反。事实上,没有两个电子的运动状态是完全相同的,B错误。根据量子力学理论可知,C错误。同一原子中,1s、2s、3s电子的能量逐渐增加,但2P、3P、4P能级的轨道数相同,D错误。
点评:本题主要考查原子结构的基本概念,难度不大,只要熟记掌握相关概念即可解决。
本题难度:简单
4、填空题 下列为元素周期表中的一部分,用化学式或元素符号回答下列问题:
?族
周期
| ⅠA
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
| 0
|
二
| ?
| ?
| ?
| ⑥
| ?
| ⑦
| bl
| ?
|
三
| ①
| ③
| ⑤
| ?
| ?
| ?
| ⑧
| ⑩
|
四
| ②
| ④
| ?
| ?
| ?
| ?
| ⑨
| ?
|
(1)11种元素中,化学性质最不活泼的是________。
(2)①②⑤中,最高价氧化物对应的水化物碱性最强的是________。
(3)元素⑦的氢化物分子式为________,该氢化物与元素①的单质反应的离子方程式是_______________________________________________。
(4)①的最高价氧化物对应的水化物的化学式为__________。①和⑨两元素形成化合物的化学式为_________________________,该化合物灼烧时焰色为________,该化合物的溶液与元素⑧的单质反应的离子方程式为??。
参考答案:(1)Ar (2)KOH (3)H2O 2K+2H2O===2K++2OH-+H2↑
(4)NaOH NaBr 黄色? Cl2+2Br-=2Cl-+Br2
本题解析:(1)稀有气体元素的最外层电子数已经达到稳定状态,所以化学性质最不活泼,因此化学性质最不活泼的是Ar元素。
(2)同周期自左向右金属性逐渐减弱,同主族自上而下金属性逐渐增强。金属性越强,最高价氧化物的水化物的碱性越强,则①②⑤中,最高价氧化物对应的水化物碱性最强的是KOH。
(3)⑦元素是氧元素,则其氢化物的化学式是H2O。K是活泼的碱金属,极易和水反应,生产氢氧化钾和氢气,反应的化学方程式是2K+2H2O=2KOH+H2↑。
(4)①是Na元素,其最高价氧化物对应的水化物的化学式为NaOH。⑨是Br元素,二者形成的化合物的化学式是NaBr,焰色反应显黄色。⑧是氯元素,氯元素的非金属性强于溴元素的,所以该化合物的溶液与元素⑧的单质反应的离子方程式为Cl2+2Br-=2Cl-+Br2。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生基础知识的巩固和训练,有利于提高学生的逻辑推理能力和应试能力。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力,考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
本题难度:一般
5、选择题 X、Y、Z、R分别代表四种元素,若aXm+、bYn+、cZn-、dRm-四种离子的核外电子数相同,且
m>n,则下列关系式正确的是(?)
A.a - c ="" m -n
B.b-d =" m" + n
C.a>b>d >c
>c
D.a>c>b>d
参考答案:B
本题解析:略
本题难度:简单