1、简答题 某研究性学习小组为探究某医药公司出品的液体补血剂中的铁元素,进行了如下实验:
I.向试管中加入液体补铁剂2mL,加入蒸馏水,振荡后发现溶液变澄清透明;滴加KSCN溶液,溶液显示淡红色.学生甲认为此补血剂含铁量很低,属不合格产品.
(1)你认为学生甲的观点合理吗?______
II.学生乙认为还应进一步探究实验,他将学生甲所得溶液分成三份,分别加入了氯水、溴水、碘水.发现加入氯水、溴水后溶液呈血红色,颜色明显加深,加入碘水的试管颜色无明显变化.请回答下列问题:
(2)根据乙的上述实验说明补血剂中的铁为______价.
(3)向补血剂溶液中滴加KSCN溶液,显示淡红色的原因______.
(4)请写出加入氯水后对应的离子反应方程式______.
(5)请根据乙同学的实验现象进一步推断,氯、溴的单质可将铁单质氧化成______价铁,而Fe与I2反应的产物应该是______.
III.学生丙也做了与学生甲同样的实验,将所得的淡红色溶液分成两份继续进行实验:
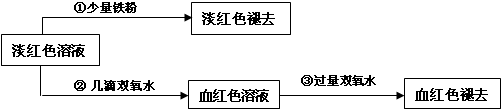
试回答下列问题:
(6)请写出丙的实验①中淡红色褪去的离子方程式______.
(7)关于③中的实验现象,丙同学提出了假设:过量的双氧水将SCN-氧化了.请你设计一个实验方案验证丙的假设______.
参考答案:(1)因补血剂的成分是Fe2+,滴加KSCN溶液,溶液显示淡红色,说明Fe3+的浓度低,故答案为:不合理;
(2)因加入氯水、溴水后溶液呈血红色,颜色明显加深,说明生成更多的Fe3+,而Fe2+能氧化剂如氯气、液溴所氧化,则原溶液中铁的化合价为+2价,故答案为:+2;
(3)因Fe2+氧化生成Fe3+,Fe3+遇SCN-变红,所以向补血剂溶液中滴加KSCN溶液,显示淡红色的原因有少量的亚铁离子被氧化,故答案为:有少量的亚铁离子被氧化;
(4)因Fe2+与Cl2反应生成Fe3+和Cl-:Cl2+2Fe2+=2Cl-+2Fe3+,故答案为:Cl2+2Fe2+=2Cl-+2Fe3+;
(5)根据加入氯水、溴水后溶液呈血红色,颜色明显加深,说明生成更多的Fe3+;加入碘水的试管颜色无明显变化,说明Fe2+与I2不反应;故答案为:+3,FeI2;
(6)根据Fe3+检验方法,溶液中继续加入过量KSCN溶液,若溶液变红则说明是过量的双氧水将SCN-氧化了,故答案为:
取少量加入过量双氧水后的溶液,往其中加入过量KSCN溶液,若溶液变红则说明是过量的双氧水将SCN-氧化了.
本题解析:
本题难度:一般
2、填空题 聚合硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理.用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+.实验步骤如下:
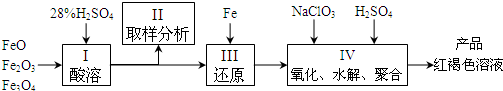
(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有______.
(a)玻璃棒 (b)烧杯? (c)烧瓶
(2)步骤II取样分析溶液中Fe2+、Fe3+的含量,目的是______和确定氧化Fe2+所需NaClO3的量:
(a)?控制溶液中Fe2+与Fe3+含量比 (b)?确保铁的氧化物酸溶完全? (c)?确定下一步还原所需铁的量
(3)完成步骤IV中的氧化还原反应:补充产物并配平:
______?Fe2++______ClO3-+______H+=______Fe3++Cl-+______
(4)聚合硫酸铁溶液中SO42?与Fe3+物质的量之比不是3:2.根据下列提供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42?与Fe3+物质的量之比.测定时所需的试剂______.
(a)?NaOH (b)?FeSO4 (c)?BaCl2 (d)?NaClO3
需要测定Fe2O3和______的质量(填写化合物的化学式).
参考答案:(1)配制一定量分数硫酸溶液需要的仪器有:胶头滴管、量筒、玻璃棒、烧杯,故选:ab;?
(2)因为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+,所以确定下一步还原所需铁的量,然后Fe2+再被氧化Fe3+,需要确定氧化Fe2+所需NaClO3的量,故选:C;?
(3)Fe2+由+2价升高到+3价,ClO3-中Cl的化合价从+5价降低到-1价,得6Fe2++ClO3-+H+--6Fe3++Cl-,由电荷守恒、质量守恒得:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O,故答案为:6;1;6;3H2O;
(4)因SO42?与Fe3+都采用沉淀法加以测定,根据测定Fe2O3来测定Fe3+的物质的量,根据测定?BaSO4的质量来测定SO42?的物质的量;故答案为:ac;?BaSO4
本题解析:
本题难度:简单
3、选择题 取少量MgO、A12O3、SiO2、Fe2O3的混合粉末,加入过量盐酸,充分反应后过滤,得到沉淀X和滤液Y。下列叙述正确的是
A.上述四种氧化物对应的水化物中,Al(OH)3酸性最强
B.向沉淀X中加入氢氟酸,沉淀X不溶解
C.溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+
D.溶液Y中加入过量氨水,所得沉淀为Fe(OH)3和Mg(OH)2
参考答案:C
本题解析:略
本题难度:一般
4、填空题 在Cu(NO3)2和AgNO3的混合溶液中加入一定量的锌粉,使之充分反应后,有下列情况:
(1)若反应后锌有剩余,则溶液中所含溶质是?。
(2)若反应后过滤,向所得固体物质加盐酸没有气体产生。则溶液中一定有?,可能有?。
(3)若反应后过滤,向滤液中滴加NaCl溶液,有不溶于稀硝酸的白色沉淀生成,则此时溶液中含有的溶质为?。
参考答案:(1)Zn(NO3)2;(2) Zn(NO3)2;Cu(NO3)2、AgNO3;(3)Zn(NO3)2、Cu(NO3)2、AgNO3。
本题解析:因为Zn在金属活动性顺序表中排在Cu和Ag的前面,所以Zn和Cu(NO3)2、AgNO3都能反应,且Zn一般是先和AgNO3反应(因为Ag排在Cu的后面,即使Zn先把Cu(NO3)2中的铜先置换出来,置换出来的Cu还要和AgNO3进一步反应)。(1)中锌有剩余,说明Cu(NO3)2、AgNO3均反应完,则溶液中所含溶质是Zn(NO3)2;(2)中Zn已完全反应,生成物中一定有Zn(NO3)2,而Cu(NO3)2和AgNO3可能反应完,也可能有剩余;(3)向滤液中滴加NaCl溶液,有不溶于稀硝酸的白色沉淀生成,说明滤液中有Ag+,即AgNO3也没有完全反应,则此时溶液中含有的溶质为:Cu(NO3)2、AgNO3、Zn(NO3)2。
本题难度:简单
5、填空题 高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示:
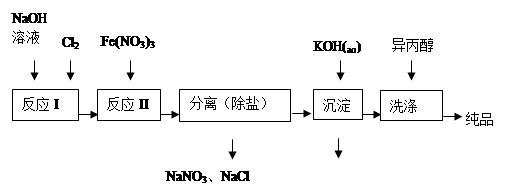
①洗涤粗品时选用异丙醇而不用水的理由是:?。
②反应II的离子方程式为?。
③高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂.它能消毒杀菌是因为??它能净水的原因是?。
④已知25℃时Fe(OH)3的Ksp = 4.0×10-38,反应II后的溶液中c(Fe3+)=4.0×10-5 mol/L,则需要调整?时,开始生成Fe(OH)3(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。①加入饱和KOH溶液的目的是:?。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠?(填“大”或“小”)。
湿法
| 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液
|
干法
| Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物
|
?
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为?。
(4)高铁电池是正在研制中的可充电干电池,高铁电池具有工作电压稳定, 放电时间长等优点,有人以高铁酸钾、二氧化硫和三氧化硫原料,以硫酸酸钾为电解质,用惰性电极设计成高温下使用的电池,写出该电池正极电极反应式:?。
参考答案:(1)①减少高铁酸钾的溶解损失(2分)
②3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O(2分)
③高铁酸钾(K2FeO4)有强氧化性? (1分)高铁酸钾的还原产物水解产生的Fe(OH)3胶体,有吸附性(有絮凝作用),使水澄清起净水作用? (1分)?④3 (2分)
(2)①增大K+浓度,促进K2FeO4晶体析出(1分)?②小 (1分)
(3)3:1? (2分)(4)2FeO42-+6e-+8SO3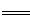 2Fe3++8SO42-(2分)
2Fe3++8SO42-(2分)
本题解析:(14分)(1)①为防止K2FeO4的溶解,可用异丙醇洗涤,所以答案是减少高铁酸钾的溶解损失。
②ClO-在碱性条件下可将Fe3+氧化为FeO42-,据题目信息和氧化还原反应中化合价发生变化确定找出反应物:Fe3+、ClO-,生成物:FeO42-、Cl-,根据电子得失守恒和质量守恒来配平,反应II的离子方程式为3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O。
③?高铁酸钾(K2FeO4)在水中能消毒杀菌是因为有强氧化性,净水的原因是高铁酸钾的还原产物水解产生的Fe(OH)3胶体,有吸附性,使水澄清起净水作用。
④Ksp =c(Fe3+)·c3(OH-)= 4.0×10-38,所以=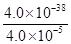 ,c(OH-)=1.0×10-11,c(H+)=1.0×10-3,pH= 3;
,c(OH-)=1.0×10-11,c(H+)=1.0×10-3,pH= 3;
(2)①加入饱和KOH溶液的目的是增大K+浓度,促进K2FeO4晶体析出;
②溶解度小的沉淀先析出来,所以高铁酸钾的溶解度比高铁酸钠;
(3)干法制备K2FeO4的反应的方程式为:Fe2O3+3KNO3+4KOH 2K2FeO4+3KNO2+2H2O,N元素化合价降低,是氧化剂,铁的化合价降低,是还原剂,氧化剂与还原剂的物质的量之比为3﹕1,
2K2FeO4+3KNO2+2H2O,N元素化合价降低,是氧化剂,铁的化合价降低,是还原剂,氧化剂与还原剂的物质的量之比为3﹕1,
(4)高铁酸钾得电子,做氧化剂,所以在正极反应的是FeO42-,电极反应式:2FeO42-+6e-+8SO3 2Fe3++8SO42-。
2Fe3++8SO42-。
本题难度:困难