1、选择题 在14.0g银铜合金中加入500mL一定浓度的浓硝酸,合金全部溶解,收集到NO2和NO体积共2.24L(标准状况下),再向该溶液中加入bml,4mol/L的NaOH溶液,刚好使溶液中的阳离子沉淀完全;若将收集到的气体全部与标准状况下的O21.12L充分混合后,通入水中二者刚好完全反应。下列有关说法不正确的的是
A.银的质量为10.8g
B.NO与NO2的体积比之比(相同条件下)为2:1
C.原硝酸的物质的量浓度 (0.1mol+4b×10-3mol)/0.5L
D.沉淀中Cu(OH)2的物质的量为0.05mol
参考答案:B
本题解析:银铜合金中加入一定浓度的浓硝酸,合金全部溶解,发生反应得到AgNO3和Cu(NO3)2,硝酸被还原从NO、NO2. 银铜失去的电子数与硝酸变为NO、NO2时得到的电子数相等。向该溶液中加入bml, 4mol/的NaOH溶液,刚好使溶液中的阳离子沉淀完全产生AgOH、Cu(OH)2.沉淀消耗的氢氧根离子的物质的量与AgNO3和Cu(NO3)2中的硝酸根离子的物质的量相等。将收集到的气体全部与标准状况下的O21.12L充分混合后,通入水中二者刚好完全反应。说明恰好完全转化为硝酸,这时氧气得到的电子数与NO、NO2产生硝酸时失去的电子数相等。A.设Cu、Ag的物质的量分别为X、Y。则64X+108Y=14;2X+Y=4×(1.12L÷22.4mol/L)解得X=0.05;Y=0.1.银的质量为0.1mol×108g/mol=10.8g.正确。B.设产生的NO、NO2的物质的量分别为m、n,则根据电子守恒的3m+n=0.05×2+0.1×1;m+n=0.1.解得m=n=0.05.所以m:n=1:1.错误。C.n(HNO3)=n(NO3-)+n(NO、NO2)=4b×10-3+2.24l÷22.4mol/L=0.1mol+4b×10-3mol.所以.原硝酸的物质的量浓度 (0.1mol+4b×10-3mol)/0.5L。正确。n(Cu)= 0.05mol.n[Cu(OH)2]=" n(Cu)=" 0.05mol. D正确。
本题难度:一般
2、填空题 某种常见的晶体A,与盐酸反应产生无刺激性气味的气体B。将B通入澄清石灰水中,石
灰水变浑浊。若在A的溶液中加氢氧化钡溶液,则析出白色沉淀C和无色气体D;D可以使湿润的红色石蕊试纸变蓝。加热固体A,可生成水、B和D,而且B和D的物质的量之比为1∶1。根据以上事实可以判断出A是__________,B是__________,C是__________。加热固体A生成水、B和D的化学方程式是__________。
参考答案:NH4HCO3? CO2? BaCO3? NH4HCO3 NH3↑+CO2↑+H2O
NH3↑+CO2↑+H2O
本题解析:由无色无味的气体B通入澄清石灰水中变浑浊,知B为CO2,说明A中含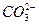 或
或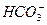 ;D能使湿润的红色石蕊试纸变蓝,D为NH3,则A中含
;D能使湿润的红色石蕊试纸变蓝,D为NH3,则A中含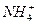 ,A受热生成的CO2和NH3物质的量比为1∶1,A为NH4HCO3。
,A受热生成的CO2和NH3物质的量比为1∶1,A为NH4HCO3。
本题难度:简单
3、选择题 相同状况下,在体积相同的三个烧瓶中分别盛NH3、HCl和NO2气体,并分别倒立在水槽里,充分溶解后烧瓶内三种溶液物质的量浓度之比为(设烧瓶内液体未扩散到水槽里)( )
A.1∶1∶1
B.2∶2∶3
C.3∶3∶2
D.2∶2∶1
参考答案:A
本题解析:盛三种气体的烧瓶倒置在水中,气体减少的体积和进入烧瓶中溶液的体积都满足相等,所得溶液的物质的量浓度均相等。
本题难度:简单
4、填空题 元素R有两种氯化物RClm和RCln,其相对分子质量之差为71,Cl的质量分数在RClm中为85%,在RClm中为77%,则:
(1)m-n=______________,m=______________,R的相对分子质量=______________;
(2)通常R有两种同素异形体,其名称是__________________和________________。
参考答案:(1)2? 5? 31?(2)白磷?红磷
本题解析:依题意易得:m-n=2。
由RClm和RCln及m-n=2可联想到PCl5和PCl3,代入验证:
PCl5中:w(Cl)=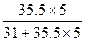 ×100%≈85%
×100%≈85%
PCl3中:w(Cl)= 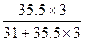 ×100%≈77%
×100%≈77%
符合题意,则RClm和RCln分别为PCl5和PCl3。
本题难度:简单
5、计算题 将容积为50 mL的量筒内充满NO2和O2的混合气体,倒置量筒在盛满水的水槽里,足够时间后,量筒里剩余气体体积为5 mL。则混合气体中NO2和O2体积比可能是__________。
参考答案:18∶7或43∶7
本题解析:二氧化氮、氧气混合气体倒置于水中,最后残留气体可能有两种情况:一是氧气,二是一氧化氮。所以应先假设,再列式计算。
(1)若剩余的5 mL气体是O2,则共有45 mL NO2、O2混合气体跟水反应,根据4NO2+?O2+2H2O====4HNO3可得出:
V(NO2)=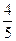 ×45 mL="36" mL
×45 mL="36" mL
V(O2)=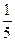 ×45 mL+5 mL="14" mL
×45 mL+5 mL="14" mL
所以,原混合气体中NO2和O2体积比为18∶7。
(2)若剩余的5 mL气体是NO,则NO2、O2混合气体跟水反应时是NO2过量,过量的NO2再跟水反应。根据反应“3NO2+H2O====2HNO3+NO”可得出,共有15 mL NO2过量。
即在NO2、O2混合气体跟水反应的过程中共消耗气体35 mL。根据4NO2+O2+2H2O====4HNO3可得出:
V(O2)=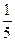 ×35 mL="7" mL
×35 mL="7" mL
V(NO2)=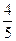 ×35 mL+15 mL="43" mL
×35 mL+15 mL="43" mL
所以,原混合气体中NO2和O2体积比为43∶7。
本题难度:简单