1、填空题 如右图所示装置用于测定某碱金属的相对原子质量。仪器本身连同水和干燥管以及其内的无水氯化钙的总质量为480.00 g。现将1.46 g某碱金属单质投入水中,立即用带有干燥管的塞子塞紧瓶口,反应完毕后,测得整套仪器的总质量为481.25 g。该金属元素的相对原子质量是________(结果保留两位小数),若不用干燥管,测得的相对原子质量比实际相对原子质量________(填“偏大”“偏小”或“相等”),理由是________________________________。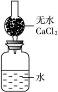
参考答案:6.95?偏小?水蒸气随氢气带出,使测得的H2的质量比实际质量偏高,计算出的碱金属的相对原子质量偏小。
本题解析:根据?
2M+2H2O====2MOH+H2↑?Δm
2Ar g? 2 g? (2Ar-2) g
1.46 g? (481.25-480.00) g
则有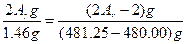
则Ar=6.95
本题难度:简单
2、选择题 下列关于Na2O2的叙述正确的是
[? ]
A.Na2O2是一种白色固体
B.Na2O2中氧元素的化合价为-2价
C.Na2O2可用作呼吸面具中的供氧剂
D.Na2O2不需要密封保存
参考答案:C
本题解析:
本题难度:一般
3、选择题 下列物质中既能跟盐酸反应,又能跟氢氧化钠溶液反应且有气体生成的是(?)
A.Na2CO3溶液
B.NaHCO3溶液
C.Al(OH)3
D.Al
参考答案:D
本题解析:略
本题难度:简单
4、计算题 18.4 g NaOH 和 NaHCO3固体混合物,在密闭容器中加热到约 250℃,经充分反应后排出气体,冷却,称得剩余固体质量为 16.6 g。试计算原混合物中 NaOH 的质量分数。
参考答案:54.3%
本题解析:发生的反应有:①2NaHCO3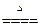 Na2CO3+H2O+CO2↑,
Na2CO3+H2O+CO2↑,
②2NaOH+CO2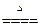 Na2CO3+H2O(加热条件下,不生成 NaHCO3)
Na2CO3+H2O(加热条件下,不生成 NaHCO3)
通过极限思维可知,原固体混合物中,NaHCO3含量越大,固体失重越大,NaOH 含量越大,固体失重越小。
判断 NaHCO3受热分解产生的 CO2能否被 NaOH 完全吸收是解决问题的关键,这首先需要写出 NaHCO3与 NaOH 恰好完全反应的化学方程式。
题设条件下,固体失重:18.4 g-16.6 g =" 1.8" g。
设固体失重 1.8 g 需恰好完全反应的 NaHCO3和 NaOH 混合物质量为 x,则:
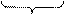 NaHCO3+NaOH
NaHCO3+NaOH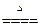 Na2CO3+H2O
Na2CO3+H2O
124 g? 18 g
?x ?1.8 g
x =  =" 12.4" g<18.4 g
=" 12.4" g<18.4 g
可见,题设条件下反应发生后 NaOH 过量,过量 NaOH 质量为:
18.4 g-12.4 g =" 6.0" g,
参加反应的 NaOH 质量为: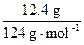 ×40.0 g·mol-1 =" 4.00" g,
×40.0 g·mol-1 =" 4.00" g,
原混合物中 NaOH 质量为:6.0 g+4.00 g =" 10.0" g,
w(NaOH) = 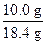 ×100% = 54.3%。
×100% = 54.3%。
答案:54.3% 。
本题难度:一般
5、选择题 xg Na2O和yg Na2O2分别加入等质量的水中(水足量),结果得到等质量分数的溶液,则x与y关系正确的是(? )
A.x=y
B.x>y
C.x<y
D.无法确定
参考答案:C
本题解析:根据Na2O+H2O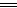 2NaOH和2Na2O2+2H2O
2NaOH和2Na2O2+2H2O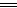 4NaOH+O2↑可知当所得溶液的质量分数相等时,过氧化钠的质量大于氧化钠的质量。
4NaOH+O2↑可知当所得溶液的质量分数相等时,过氧化钠的质量大于氧化钠的质量。
本题难度:简单