1、选择题 在水溶液中能大量共存的一组是
[? ]
A.?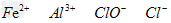 ?
?
B.?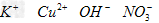 ?
?
C.? ?
?
D.?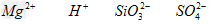 ?
?
参考答案:C
本题解析:
本题难度:一般
2、填空题 硫酸锌是制备荧光粉的原料之一。工业上由锌白矿(主要成分是ZnO,还含有Fe2O3、CuO、SiO2等杂质)制备ZnSO4?7H2O的流程如下。
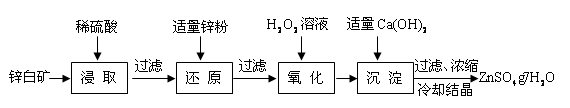
已知:常温下,溶液中的Fe3+、Zn2+、Fe2+以氢氧化物形式完全沉淀的pH分别为:3.7,6.5,9.7。
(1)浸取过程中提高浸出效率可采用的措施有 (任答一条),
ZnO和硫酸反应的化学方程式为 。
(2)加入适量锌粉的作用为:①使溶液中的Fe3+转化为Fe2+;② 。
(3)氧化过程中H2O2发生反应的离子方程式为 。
(4)加入适量Ca(OH)2调节溶液pH,促进Fe3+水解,Fe3+水解反应的平衡常数表达式
K= ,Ca(OH)2不能过量的原因是 。
参考答案:(12分)
(1)将矿石粉碎或提高浸取温度或适当增加酸的浓度等(2分)?
ZnO+H2SO4=ZnSO4+H2O(2分)
(2)除去Cu2+(2分)
(3)H2O2+2Fe2++2H+=2Fe3++2H2O(2分)
(4)c3(H+)/c(Fe3+) (2分)?防止生成Zn(OH)2(2分)
本题解析:(1)浸出步骤硫酸同固体废料中主要成份反应,从化学反应速率和化学平衡的影响因素来看,可通过升高温度提高硫酸锌的溶解度,或通过搅拌使反应物充分接触反应,或通过过滤后滤渣多次浸取以提高转化率,故答案为:适当提高反应温度、增加浸出时间(或其他合理答案);ZnO和硫酸反应的化学方程式为ZnO+H2SO4=ZnSO4+H2O,故答案为: ZnO+H2SO4=ZnSO4+H2O;⑵加入锌粉,发生以下反应:Zn+2H+=Zn2++H2↑,Zn+2Fe3+=2Fe2++Zn2+ ,Fe+Cu2+ =Cu+Zn2+ ,Zn过量后:Fe2++Zn=Fe+Zn2+ ,所以题目中加入适量的锌粉,②除去Cu2+ ,答案:除去Cu2+;⑶H2O2将Fe2+ 氧化成Fe3+ 便于在pH较低的条件下,利用水解除去Fe3+ ,答案:H2O2+2Fe2++2H+=2Fe3++2H2O;⑷根据水解方程式Fe3++3H2O Fe(OH)3+3H+ ,写出平衡常数K= c3(H+)/c(Fe3+) ;Ca(OH)2不能过量的原因是:Fe3+ 在pH为1.1―3.2时沉淀,pH在5.9―8.9时Zn2+ 沉淀,答案:c3(H+)/c(Fe3+);防止生成Zn(OH)2。
Fe(OH)3+3H+ ,写出平衡常数K= c3(H+)/c(Fe3+) ;Ca(OH)2不能过量的原因是:Fe3+ 在pH为1.1―3.2时沉淀,pH在5.9―8.9时Zn2+ 沉淀,答案:c3(H+)/c(Fe3+);防止生成Zn(OH)2。
本题难度:困难
3、填空题 离子中的若干种:K+、NH+4、Cl-、Mg2+、Ba2+、CO23、SO2-4,现取三份溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀生成。
(2)第二份加入足量NaOH溶液并加热后,收集到气体0.04mol。
(3)第三份加入足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤,干燥后,沉淀质量为2.33g。根据上述实验,作出判断:
溶液中一定存在的离子是?
该溶液中一定不存在的离子是?
该溶液中可能存在的离子是?
参考答案:CO2-3、SO2-4、NH+4、K+、Mg2+、Ba2+、Cl-、
本题解析:略
本题难度:一般
4、选择题 在溶液中加入足量Na2O2后仍能大量共存的离子组是( )
A.NH4+、Ba2+、Cl-、NO3-
B.K+、AlO2-、Cl-、SO42-
C.Ca2+、Mg2+、NO3-、HCO3-
D.Na+、Cl-、CO32-、SO32-
参考答案:A.NH4+与OH-反应而不能大量共存,故A错误;
B.在碱性条件下,离子之间不发生任何反应,可大量共存,故B正确;
C.Mg2+与OH-反应,Ca2+、HCO3-与OH-反应生成沉淀而不能大量共存,故C错误;
D.SO32-具有还原性,可与Na2O2发生氧化还原反应,故D错误.
故选B.
本题解析:
本题难度:简单
5、选择题 下列各组离子,在指定条件下,一定不能大量共存的是(? )
①能与铝反应产生H2的溶液中:Fe2+、Cl-、NH4+、NO3-
②pH=8.4的弱碱性溶液中:Na+、K+、AlO2-、HCO3-
③能使pH试纸变深蓝色的溶液中:Na+、K+、AlO2-、CO32-
④在c(H+): c(OH-)=1:1012的溶液中:Na+、I-、NO3-、SO42-
⑤常温下水电离出的c(H+)·c(OH-)=1:10-20的溶液中:Na+、Cl-、S2-、SO32-
⑥水电离出的c(H+)=1×10-12mol/L的溶液中:Fe3+、NH4+、Cl-、NO3-
A.①③
B.①②
C.②④
D.①②⑤⑥
参考答案:B
本题解析:①中溶液可能显酸性,也可能显碱性,不能大量共存。AlO2-、HCO3-发生反应生成氢氧化铝沉淀,②不能大量共存。能使pH试纸变深蓝色的溶液,显碱性,可以大量共存。c(H+): c(OH-)=1:1012的溶液,说明显碱性,可以大量共存。水电离出的c(H+)·c(OH-)=1:10-20的溶液,说明溶液可能显酸性,也可能显碱性,若显碱性能大量共存。水电离出的c(H+)=1×10-12mol/L的溶液,说明水的电离被抑制,溶液可能显酸性,也可能显碱性,若显酸性能大量共存。答案选B。
本题难度:一般