1、选择题 用NA表示阿伏加德罗常数的数值,下列说法正确的是
A.23gNO2和N2O4的混合气体中含有的氮原子数为0.5NA
B.4.2 g丙烯中所含的共用电子对总数为0.6NA
C.过氧化氢分解制得标准状况下1.12 L O2,转移电子数目为 0.2 NA
D.在高温、高压、催化剂的条件下,28gN2和6gH2充分反应,生成NH3的分子数为2NA
参考答案:A
本题解析:A、23gNO2和N2O4的混合气体中含有的氮原子数=23÷46×NA ="0.5" NA,正确; B、4.2 g丙烯中所含的共用电子对总数为0.9NA,错误; C、氧元素由-1价变为0价,0.05mol 产生O2转移电子数目为 0.1NA,错误;D、该反应为可逆反应,反应物不能完全转化为氨气,错误。
本题难度:一般
2、选择题 人造空气(氧气O2与氦气He的混合气)可用于减轻某些病痛或供深水潜水员使用。在标准状况下,5.6L“人造空气”的质量是2.4g,其中氧气与氦气的质量比是? (? )
A.1:1
B.1∶4
C.2:1
D.2:3
参考答案:C
本题解析:5.6L“人造空气”的质量是2.4g,则22.4L人造空气的质量为2.4×4=9.6g;即混合气体的平均相对分子质量为9.6;利用“十字交叉”法得:物质的量的关系为:
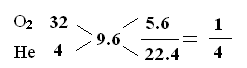
所以可求得氧气与氦气的质量比是2:1
本题难度:一般
3、计算题 (10分)实验室在加热条件下制取Cl2的化学方程式为:MnO2+4HCl(浓)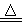 MnCl2+Cl2↑+2H2O。现将17.4 g MnO2投入到400 g质量分数为36.5%的浓盐酸(浓盐酸过量)中加热,充分反应后(不考虑盐酸挥发),求:
MnCl2+Cl2↑+2H2O。现将17.4 g MnO2投入到400 g质量分数为36.5%的浓盐酸(浓盐酸过量)中加热,充分反应后(不考虑盐酸挥发),求:
(1)标准状况下生成Cl2的体积为多少?
(2)剩余HCl的物质的量为多少?
参考答案:4.48L;3.2mol
本题解析:
试题解析:8.7MnO2的物质的量=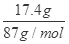 =0.2mol,则:
=0.2mol,则:
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
1 4 1
0.2mol n(HCl) n(Cl2)
n(Cl2)=n(MnO2)==0.2mol,V(Cl2)=22.4L/mol×0.2mol=4.48L;(2)原溶液中氯化氢的物质的量=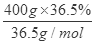 =4mol,反应过程中消耗的氯化氢的物质的量=0.2mol×4=0.8mol,故反应后剩余氯化氢的物质的量=4mol-0.8mol=3.2mol。
=4mol,反应过程中消耗的氯化氢的物质的量=0.2mol×4=0.8mol,故反应后剩余氯化氢的物质的量=4mol-0.8mol=3.2mol。
考点:化学方程式的有关计算
本题难度:一般
4、填空题 相对分子质量为M的某物质在室温下的溶解度为S g,此时测得饱和溶液的密度为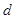 g/cm3,则该饱和溶液的物质的量浓度为
g/cm3,则该饱和溶液的物质的量浓度为
参考答案: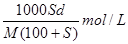
本题解析:室温下该物质的溶解度为S g的物质的量为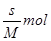 ,溶液的体积为
,溶液的体积为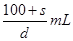 ,故该饱和溶液的物质的量浓度为
,故该饱和溶液的物质的量浓度为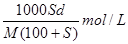 。
。
考点:物质的量浓度计算
点评:考查物质的量浓度计算,难度不大,解题时要找出计算所需的化学量,注意溶液的总质量是(100+S),而不是S。
本题难度:一般
5、选择题 某氯化镁溶液的密度为1.18g/cm3,其中镁离子的质量分数为5.1%,300mL该溶液中Cl-离子的物质的量约等于
[? ]
A. 0.37mol
B. 0.63mol
C. 0.74mol
D. 1.5mol
参考答案:D
本题解析:
本题难度:简单