1、选择题 在一个容积为2L的密闭容器中,发生如下反应:3A + B  ?2C (A、B、C均为气体),若最初加入的A、B都是4 mol,A的平均反应速率为0.12 mol/(L·s),则10s后容器中的B是
?2C (A、B、C均为气体),若最初加入的A、B都是4 mol,A的平均反应速率为0.12 mol/(L·s),则10s后容器中的B是
A、2.8 mol ? B、3.2mol C、1.6 mol D、3.6 mol
参考答案:B
本题解析:A的平均反应速率为0.12 mol/(L·s),则消耗A的物质的量是0.12 mol/(L·s)×2L×10s=2.4mol,因此根据方程式可知,消耗B是0.8mol,所以此时B的物质的量是4mol-0.8mol=3.2mol,答案选B。
本题难度:一般
2、填空题 以下是一些物质的熔沸点数据(常压):
| 钾
| 钠
| Na2CO3
| 金刚石
| 石墨
|
熔点(℃)
| 63.65
| 97.8
| 851
| 3550
| 3850
|
沸点(℃)
| 774
| 882.9
| 1850(分解产生CO2)
| ----
| 4250
|
金属钠和CO2在常压、890℃发生如下反应:4 Na(g)+ 3CO2(g)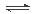 2 Na2CO3(l)+ C(s,金刚石) △H=-1080.9kJ/mol
2 Na2CO3(l)+ C(s,金刚石) △H=-1080.9kJ/mol
(1)若反应在10L密闭容器、常压下进行,温度由890℃升高到1860℃,若反应时间为10min, 金属钠的物质的量减少了0.2mol,则10min内CO2的平均反应速率为 。
(2)高压下有利于金刚石的制备,理由是 。
(3)由CO2(g)+ 4Na(g)=2Na2O(s)+ C(s,金刚石) △H=-357.5kJ/mol;则Na2O固体与C(金刚石)反应得到Na(g)和液态Na2CO3(l)的热化学方程式 。
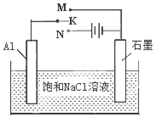
(4)下图开关K接M时,石墨电极反应式为 。
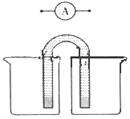
(5)请运用原电池原理设计实验,验证Cu2+、Ag+氧化性的强弱。
在方框内画出实验装置图,要求用烧杯和盐桥(在同一烧杯中,
电极与溶液含相同的金属元素),并标出外电路电子流向。
参考答案:(1)0.0015 mol/(L ·min)(2分)
(2)增大压强加快反应速率,反应向正反应方向移动(2分);
(3)3Na2O(s)+C(s,金刚石) = 4Na(g)+Na2CO3(l)△H= —4.2kJ/mol(2分);
(4)O2+2H2O+4e- =4OH-(2分);
(5) (2分)
(2分)
本题解析:(1)先根据定义式求v(Na),再根据速率之比等于化学方程式中的系数之比求v(CO2),即v(Na) =0.0020mol/(L?min), v(CO2)="3" v(Na)/4=0.0015mol/(L?min);(2)增大压强加快反应速率,反应向正反应方向移动;(3)将已知两个热化学方程式编号为①②,①—②×3可以约去3 CO2(g),根据盖斯定律,则6Na2O(s)+2C(s,金刚石)=8Na(g)+2Na2CO3(l) △H=—8.4kJ/mol,若系数减半,则焓变也减半,则3Na2O(s)+ C(s,金刚石)=4Na(g)+Na2CO3(l) △H=—4.2kJ/mol;(4)若K接M,则该装置为原电池,模拟铝的吸氧腐蚀,由于铝比石墨活泼,则铝是负极,石墨是正极,负极反应式为Al—3e—=Al3+,正极反应式为O2+4e—+2H2O=4OH—;(5)验证Cu2+、Ag+氧化性的强弱,可根据置换反应:
Cu+2Ag+=Cu2++2Ag来设计原电池,铜发生氧化反应,银离子发生还原反应。所以铜作负极,银作正极,硫酸铜和硝酸银作电解质溶液。
考点:考查化学反应速率、化学平衡、电化学等相关知识。
本题难度:困难
3、选择题 下列说法正确的是 (?)
A.活化分子相互碰撞即可发生化学反应
B.升高温度会加快化学反应速率,其原因是增加了活化分子的百分率
C.某一反应的活化分子百分率是个定值
D.浓度增大使得反应物分子中的活化分子百分率增大
参考答案:B
本题解析:活化分子发生“有效碰撞”可发生化学反应,故A错误;随着外界条件的变化,活化分子百分率会发生变化,如:升温活化分子数增多,则活化分子百分率增大;加催化剂,改变反应路径,降低反应的活化能,则活化分子百分率增大;故C错误;比如开始分子有100个,百分比是20%,那活化分子数是20,现在增加浓度,从100到200,活化分子数从20到40,但是百分比还是20%,故D错误;故选B。
本题难度:一般
4、选择题 下列有关放热反应、吸热反应的说法不正确的是
[? ]
A.吸热反应的发生都需要加热,吸热反应都没有利用价值
B.若某反应正向进行时为放热反应,则该反应逆向进行时必为吸热反应
C.放热反应放出热量的多少与反应物的质量和状态有关
D.不管是吸热反应还是放热反应,升高温度,反应速率均增大
参考答案:A
本题解析:
本题难度:简单
5、选择题 在2L密闭容器内,某气体反应物在2s内由8mol变为7.2mol,则该反应的平均反应速率为()
A.0.4mol/(L·s)
B.0.3mol/(L·s)
C.0.2mol/(L·s)
D.0.1mol/(L·s)
参考答案:C
本题解析:反应速率通常用单位时间内浓度的变化量来表示,所以反应速率等于
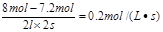 ?,答案选C。
?,答案选C。
本题难度:一般