1、选择题 将一定体积的稀硝酸平均分成两份,在其中一份中加入足量铜粉,生成的气体在标准状况下的体积为V1;在另一份中先加入与其体积相等的稀硫酸,再加入足量铜粉同,生成的气体在标准状况下的体积为V2,已知V2=3V1。则稀硝酸和稀硫酸的物质的量浓度之比为
A.1:1
B.1:2
C.1:3
D.1:4
参考答案:B
本题解析:
本题难度:困难
2、选择题 (15分)硫酸铁铵[aFe2(SO4) 3·b(NH4) 2SO4·cH2O]广泛用于城镇生活饮用水、工业循环水的净化处理等。某化工厂以硫酸亚铁(含少量硝酸钙)和硫酸铵为原料,设计了如下工艺流程制取硫酸铁铵。

请回答下列问题:
(1)硫酸亚铁溶液加H2SO4酸化的主要目的是____________________________,滤渣A的主要成分是__________________。
(2)下列物质中最适合的氧化剂B是?;反应的离子方程式?。
a.NaClO? b.H2O2? c.KMnO4? d.K2Cr2O7
(3)操作甲、乙的名称分别是:甲______________,乙___________________。
(4)上述流程中,用足量最适合的氧化剂B氧化之后和加热蒸发之前,需取少量检验Fe2+是否已全部被氧化,所加试剂为?(写名称),能否用酸性的KMnO4溶液???(如果能,下问忽略),理由是:?。(可用文字或方程式说明)
(5)检验硫酸铁铵中NH4+的方法是?。
(6)称取14.00 g所得样品,将其溶于水配制成100 mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到2.14 g沉淀;向另一份溶液中加入0.05 mol Ba (NO3)2溶液,恰好完全反应。则该硫酸铁铵的化学式为______________________。
参考答案:
(1)增大溶液中SO42-浓度,将Ca2+转化为沉淀,同时抑制Fe2+、 Fe3+水解;CaSO4.
(2)b;H2O2+2Fe2++2H+=2Fe2++2H2O
(3)冷却结晶;常温晾干
(4)铁氰化钾溶液;不能,因为过氧化氢和二价铁离子均能使酸性高锰酸钾溶液褪色
(5)在试管中加入少量样品和氢氧化钠固体加热,在试管口用湿润的红色石蕊试纸检验,看到试纸变成蓝色。(6)Fe2(SO4)3·2(NH4)2SO4·2H2O
本题解析:(1)增大溶液中SO42-浓度,将Ca2+转化为沉淀,同时抑制Fe2+、 Fe3+水解;CaSO4.
(2)b是绿色氧化剂,而别的试剂都会引入新的杂质;H2O2+2Fe2++2H+=2Fe2++2H2O
(3)冷却结晶;常温晾干
(4)检验二价铁离子应该使用黄色的铁氰化钾K3〔Fe(CN)6〕溶液;二价铁离子与铁氰根离子反应生成带有特征蓝色的铁氰化亚铁沉淀:3Fe2++2〔Fe(CN)6〕3-=Fe3〔Fe(CN)6〕2↓;不能,因为过氧化氢和二价铁离子均能使酸性高锰酸钾溶液褪色
(5)在试管中加入少量样品和氢氧化钠固体加热,在试管口用湿润的红色石蕊试纸检验,看到试纸变成蓝色,则证明原溶液中含有氨根离子。
(6)14.00 g所得样品中,加入氢氧化钠得到2.14 g沉淀为氢氧化铁,所以
n(Fe)=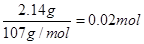
 向另一份溶液中加入0.05 mol Ba (NO3)2溶液,恰好完全反应生成硫酸钡沉淀。因此溶液中的硫酸根离子为0.05 mol ;也就是其中含有的Fe2(SO4)3为0.01 mol,(NH4)2SO4为0.02 mol ,此时质量为:0.01 mol ×400g/mol+0.02 mol ×132g/mol=6.64g,剩下的就是H2O的质量,那么每一份溶液中水的质量为:7.00g-6.64g=0.36g,n(H2O)=0.02 mol,因此该硫酸铁铵的化学式为:Fe2(SO4)3·2(NH4)2SO4·2H2O
向另一份溶液中加入0.05 mol Ba (NO3)2溶液,恰好完全反应生成硫酸钡沉淀。因此溶液中的硫酸根离子为0.05 mol ;也就是其中含有的Fe2(SO4)3为0.01 mol,(NH4)2SO4为0.02 mol ,此时质量为:0.01 mol ×400g/mol+0.02 mol ×132g/mol=6.64g,剩下的就是H2O的质量,那么每一份溶液中水的质量为:7.00g-6.64g=0.36g,n(H2O)=0.02 mol,因此该硫酸铁铵的化学式为:Fe2(SO4)3·2(NH4)2SO4·2H2O
本题难度:一般
3、实验题 (16分)某只含有CaCl2和Na2SO4杂质的粗盐样品,加水得到混合物A后,某实验小组的同学设计了如下实验步骤,请按要求回答有关问题。
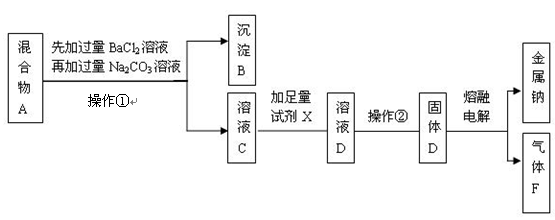
(1)在混合物A中先加过量的BaCl2溶液除去的离子是??;充分搅拌后,再加过量的Na2CO3溶液可除去的离子是??。
(2)在溶液C中加入的足量试剂X是 ?。
(3)操作②的分离方法分别是?。
(4)漂白液的有效成分是NaClO,可用气体F与NaOH溶液反应制得,该反应的化学方程式为?。
参考答案:(1)SO42-;Ba2+,Ca2+(2)HCl溶液(3)蒸发结晶
(4)Cl2+ 2NaOH="=NaCl" +NaClO +H2O
本题解析:(1)氯化钡能与硫酸钠反应生成硫酸钡沉淀和氯化钠,因此加入氯化钡溶液是除去硫酸钠的;碳酸钠能与氯化钙反应产生碳酸钙沉淀,能与氯化钡反应产生碳酸钡沉淀,因此加入碳酸钠溶液的目的是除去原混合物中的氯化钙以及过量的氯化钡;
(2)溶液C中含有过量的碳酸钠和氯化钠,加入试剂x将碳酸钠转化成氯化钠,因此加入的x是盐酸,反应的化学方程式为2HCl+Na2CO2=2NaCl+CO2↑+H2O;
(3)操作①是将固体与液体分离,用过滤法,操作②是将氯化钠溶液中氯化钠结晶析出,应用蒸发溶剂的方法.
(4)Cl2与NaOH溶液反应方程式为:Cl2+ 2NaOH="=NaCl" +NaClO +H2O。
点评:本题主要考了在粗盐提纯的试验中对杂质进行转换的探究,除去杂质的同时不能引入新的杂质。
本题难度:一般
4、填空题 除去下列各物质中的杂质。可供选择的试剂有:①盐酸,②水;可采用的方法有:A.冷却结晶,B.过滤,C.蒸发结晶,D.分液。
请将有关的试剂、操作方法的编号填入相应的横线上。
(1) 碳酸钙中混有少量的碳酸钠:_______,_______。
(2) 氯化钾中混有少量的碳酸钾:_______,_______。
(3) 氯化钠中混有少量的硝酸钾:_______,_______。
(4) 碳粉中混有少量的氧化铜:_______,________。
参考答案:(1)②;B
(2)①;C
(3)②;C
(4)①;B
本题解析:
本题难度:一般
5、简答题 下列物质中的杂质(括号中是杂质)分别可以用什么方法除去.
(1)酒精(水):试剂______方法______
(2)乙烷(乙烯):试剂______方法______
(3)溴水(水):试剂______方法______.
参考答案:(1)酒精与水混溶,利用沸点不同分离,则除去酒精中的水,可加生石灰后蒸馏,故答案为:生石灰;蒸馏;
(2)乙烯与溴水反应,而乙烷不能,则选溴水利用洗气法可除杂,故答案为:溴水;洗气;
(3)溴不易溶于水,易溶于有机溶剂,则选试剂苯(或四氯化碳)萃取后,再分液、蒸馏得到溴,故答案为:苯(或四氯化碳);萃取、分液、蒸馏.
本题解析:
本题难度:一般