1、选择题 用NA表示阿伏加德罗常数的值.下列说法正确的是
A.1?mol/LCuCl2溶液中含有Cl-的个数为2NA
B.14?g?CnH2n中含有的共用电子对数为NA
C.电解精炼铜时,每转移2?mol电子阳极上溶解的铜原子数为NA
D.标准状况下11.2?L?NH3溶于1?L水中,溶液中含N原子的微粒总数为0.5NA
参考答案:D
本题解析:分析:A、溶液中离子数目与离子浓度、溶液体积有关.
B、根据原子最外层电子数计算每个CnH2n分子中含有共用电子对数为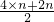 =3n对,根据n=
=3n对,根据n=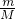 计算14gCnH2n的物质的量,再根据N=nNA计算共用电子对数.
计算14gCnH2n的物质的量,再根据N=nNA计算共用电子对数.
C、电解精炼铜时,阳极放电物质除铜外还有其它物质.
D、根据n=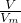 计算氨气的物质的量,根据氮原子守恒可知,溶液中氮原子数目等于11.2LNH3含有的氮原子数目.
计算氨气的物质的量,根据氮原子守恒可知,溶液中氮原子数目等于11.2LNH3含有的氮原子数目.
解答:A、1?mol/LCuCl2溶液中氯离子浓度为2mol/L,液中离子数目与离子浓度、溶液体积有关,溶液体积为告诉,无法计算离子浓度,故A错误;
B、14gCnH2n的物质的量为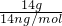 =
=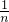 mol,每个CnH2n分子中含有共用电子对为3n对,所以,14gCnH2n中含有的共用电子对数为3NA,故B错误;
mol,每个CnH2n分子中含有共用电子对为3n对,所以,14gCnH2n中含有的共用电子对数为3NA,故B错误;
C、电解精炼铜时,若只有铜放电每转移2mol电子阳极上溶解的铜原子数为NA,阳极放电物质除铜外还有其它物质,所以溶解的铜原子数小于NA,故C错误;
D、标准状况下11.2LNH3的物质的量为0.5mol,根据氮原子守恒可知,溶液中氮原子数目等于11.2LNH3含有的氮原子数目为0.5NA,故D正确.
故选:D.
点评:考查常用化学计量有关计算,难度中等,注意B选项中共用电子对数目的计算.
本题难度:困难
2、选择题 0.5mol某气体的质量是17g,该气体可能是
A.O2
B.N2
C.CO2
D.H2S
参考答案:D
本题解析:分析:依据n×M=m来计算摩尔质量分析判断;计算各选项的物质摩尔质量对比解答;
解答:依据n×M=m定量关系计算得到气体摩尔质量:M=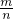 =
=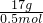 =34g/mol;
=34g/mol;
A.O2的摩尔质量为32g/mol,故A不选;
B.N2的摩尔质量为28g/mol,故B不选;
C.CO2的摩尔质量为44g/mol,故C不选;
D.H2S的摩尔质量为34g/mol,故D选;
故选D.
点评:本题考查物质的量的有关计算,明确以物质的量为中心的计算公式即可解答,难度不大.
本题难度:简单
3、选择题 设NA为阿伏加德罗常数的值,下列有关叙述不正确的是
A.标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为NA
B.1mol羟基(-OH)所含的电子总数为9NA
C.14g乙烯、丙烯的混合气体中所含原子总数为3NA
D.0.5mol1,3-丁二烯分子中含有C=C双键数为NA
参考答案:A
本题解析:分析:A、标准状况下,庚烷是液体不能使用气体摩尔体积;
B、1个羟基含有9个电子,根据N=nNA计算电子数;
C、乙烯、丙烯最简式相同为CH2,根据n=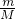 计算最简式的物质的量,再根据N=nNA计算原子数;
计算最简式的物质的量,再根据N=nNA计算原子数;
D、1,3-丁二烯分子中含有2个C=C双键,根据N=nNA计算C=C双键数.
解答:A、标准状况下,庚烷是液体,不能使用气体摩尔体积22.4L/mol,故A错误;
B、1个羟基含有9个电子,1mol羟基(-OH)所含的电子总数为1mol×9×NAmol-1=9NA,故B正确;
C、乙烯、丙烯最简式相同为CH2,最简式的物质的量为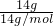 =1mol,所以14g乙烯、丙烯的混合气体中所含原子总数为1mol×3×NAmol-1=3NA,故C正确;
=1mol,所以14g乙烯、丙烯的混合气体中所含原子总数为1mol×3×NAmol-1=3NA,故C正确;
D、1,3-丁二烯分子中含有2个C=C双键,0.5mol1,3-丁二烯分子中含有C=C双键数为0.5mol×2×NAmol-1=NA,故D正确.
故选A.
点评:本题考查阿伏伽德罗常数的有关计算,难度不大,注意气体摩尔体积的使用范围与条件.
本题难度:简单
4、选择题 NA?为阿佛加德罗常数,下列叙述正确的是
A.22.4LO3气体含有O3分子数为NA
B.常温常压下,4.6?g?NO2气体含有的原子总数为0.3?NA
C.1L?0.5?mol/L?CuCl2溶液中含有Cu2+数为0.5?NA
D.标准状况下,33.6?L?H2O含有H2O分子数为1.5?NA
参考答案:B
本题解析:分析:A.不一定是在标准状况下;
B.质量和微粒数目之间的关系式:N=nNA=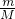 NA;
NA;
C.CuCl2溶液中的铜离子水解,所以含有Cu2+数小于0.5?NA;
D.气体摩尔体积22.4L/mol必须适用于标况下的气体物质,水在标准状况下不是气体;
解答:A.因22.4LO3气体不一定是在标准状况下,Vm未知,无法计算,故A错误;
B.1个NO2气体分子中含有3个原子,常温常压下,4.6?g?NO2气体含有的原子总数为N=n×3NA=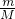 ×3NA=
×3NA=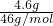 ×3NA=0.3NA,故B正确;
×3NA=0.3NA,故B正确;
C.根据n=c×v,1L?0.5?mol/L?CuCl2溶液中含有Cu2+数为0.5?NA,但铜离子水解,所以所含的Cu2+数小于0.5?NA,故C错误;
D.标准状况下,水呈液态,故33.6L的水并不是1.5mol,故D错误;
故选B.
点评:本题考查了阿伏伽德罗常数的应用,主要考查气体摩尔体积的条件应用,质量换算物质的量计算微粒数,溶液浓度和体积的计算关系分析、盐的水解,题目较简单.
本题难度:困难
5、选择题 下列说法正确的是
A.NaOH的摩尔质量为40?g
B.1?mol?02 的质量与它的相对分子质量相等
C.1?mol?OH-的质量为17 g?mol-1?
D.氖气的摩尔质量(单位g?mol-1)在数值上等于它的相对原子质量
参考答案:D
本题解析:分析:A、摩尔质量是单位物质的量的 物质的质量;单位是g/mol;
B、1 mol 02 的质量与它的相对分子质量数值上相等;
C、质量单位是g;
D、氖气是单原子分子,它的摩尔质量在数值上等于它的相对原子质量.
解答:A、NaOH的摩尔质量为40 g/mol,故A错误;
B、1 mol 02 的质量数值上与它的相对分子质量相等,故B错误;
C、1 mol OH-的质量为17 g,故C错误;
D、氖气是单原子分子,氖气的摩尔质量(单位g?mol-1)在数值上等于它的相对原子质量,故D正确;
故选D.
点评:本题考查了摩尔质量的概念和计算应用,理解概念的实质和数值确定,单位判断是解题关键,题目较简单.
本题难度:一般