1、选择题 下列各物质中所含氢原子个数与3.2gO2分子数相同的物质是
A.0.2gNH3
B.6.02×1023个H2SO4分子
C.0.1molHCl分子
D.标准状况下1.12LCH4
参考答案:C
本题解析:分析:利用n= 来计算氧气的物质的量,再利用n=
来计算氧气的物质的量,再利用n= 、n=
、n= 、n=
、n= 及物质的构成来计算氢原子的物质的量,若氢原子的物质的量与氧气的物质的量相等,则个数相同.
及物质的构成来计算氢原子的物质的量,若氢原子的物质的量与氧气的物质的量相等,则个数相同.
解答:3.2gO2的物质的量为 =0.1mol,
=0.1mol,
A、氨气的物质的量为 =0.012mol,氢原子的物质的量为0.012mol×3=0.036mol,故A错误;
=0.012mol,氢原子的物质的量为0.012mol×3=0.036mol,故A错误;
B、H2SO4分子的物质的量为 =1mol,氢原子的物质的量为1mol×2=2mol,故B错误;
=1mol,氢原子的物质的量为1mol×2=2mol,故B错误;
C、0.1molHCl分子中氢原子的物质的量为0.1mol×1=0.1mol,故C正确;
D、标准状况下甲烷的物质的量为 =0.5mol,氢原子的物质的量为0.5mol×4=2mol,故D错误;
=0.5mol,氢原子的物质的量为0.5mol×4=2mol,故D错误;
故选C.
点评:本题考查学生利用n= 、n=
、n= 、n=
、n= 及物质的构成进行的简单计算,明确氢原子的个数与氧分子数相同,即选项中氢原子的物质的量与氧气的物质的量相等是解答本题的关键.
及物质的构成进行的简单计算,明确氢原子的个数与氧分子数相同,即选项中氢原子的物质的量与氧气的物质的量相等是解答本题的关键.
本题难度:困难
2、选择题 下列说法正确的是
A.NaOH的摩尔质量为40?g
B.1?mol?02 的质量与它的相对分子质量相等
C.1?mol?OH-的质量为17 g?mol-1?
D.氖气的摩尔质量(单位g?mol-1)在数值上等于它的相对原子质量
参考答案:D
本题解析:分析:A、摩尔质量是单位物质的量的 物质的质量;单位是g/mol;
B、1 mol 02 的质量与它的相对分子质量数值上相等;
C、质量单位是g;
D、氖气是单原子分子,它的摩尔质量在数值上等于它的相对原子质量.
解答:A、NaOH的摩尔质量为40 g/mol,故A错误;
B、1 mol 02 的质量数值上与它的相对分子质量相等,故B错误;
C、1 mol OH-的质量为17 g,故C错误;
D、氖气是单原子分子,氖气的摩尔质量(单位g?mol-1)在数值上等于它的相对原子质量,故D正确;
故选D.
点评:本题考查了摩尔质量的概念和计算应用,理解概念的实质和数值确定,单位判断是解题关键,题目较简单.
本题难度:一般
3、选择题 用NA表示阿伏加德罗常数的值,下列说法正确的是
A.100mL?0.1mol/L Na2SO4溶液中,粒子总数是0.03NA
B.1mol Fe3+完全水解生成氢氧化铁胶体粒子的数目为NA
C.常温常压下,32g?O2-中所含电子的数目为20NA
D.标准状况下,分子数为NA的N2,C2H4混合气体的质量无法确定
参考答案:C
本题解析:分析:A.根据Na2SO4溶液中的组成和硫酸钠在水中的电离来分析解答;
B.氢氧化铁胶体微粒是氢氧化铁微粒的集合体;
C.1个O2-中所含电子的数目为10个,1molO2-中所含电子的数目为10NA;
D.N2、C2H4的摩尔质量都是28?g/mol.
解答:A.Na2SO4溶液中有水和Na2SO4,Na2SO4属于盐类化合物,在水中电离成钠离子和硫酸根离子,100mL?0.1mol/L Na2SO4溶液中钠离子和硫酸根离子总数是0.03NA,但粒子含水分子,所以粒子总数远大于0.03NA,故A错误;
B.1mol?FeCl3完全水解转化为氢氧化铁胶体,氢氧化铁假体微粒是氢氧化铁的集合体,生成胶粒小于NA个;故B错误;
C.常温常压下,32g?O2-中的物质的量为n=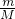 =
=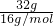 =2mol,1molO2-中所含电子的数目为10NA,2molO2-中所含电子的数目为20NA,故C正确;
=2mol,1molO2-中所含电子的数目为10NA,2molO2-中所含电子的数目为20NA,故C正确;
D.标准状况下,分子数为NA的N2、C2H4混合气体的物质的量为1mol,N2、C2H4的摩尔质量都是28?g/mol,所以该混合气体的质量为28克,故D错误;
故选C.
点评:本题考查了阿伏伽德罗常数的应用,注意Na2SO4溶液中的组成、胶体的微粒、O2-中所含电子的数目、N2和C2H4的摩尔质量是解答的关键,题目难度不大.
本题难度:困难
4、选择题 50mL 0.6mol?L-1NaOH溶液,含NaOH的物质的量为
A.0.03?mol
B.0.04?mol
C.0.05?mol
D.0.06?mol
参考答案:A
本题解析:分析:根据n=cV计算氢氧化钠的物质的量.
解答:50mL0.6mol?L-1NaOH溶液,含NaOH的物质的量为0.05L×0.6mol/L=0.03mol,故选A.
点评:本题考查物质的量浓度的有关计算,比较基础,旨在考查学生对基础知识的理解掌握.
本题难度:困难
5、选择题 用NA代表阿佛加德罗常数,下列说法不正确的是
A.48gO3气体含有NA个O3分子
B.常温常压下,活泼金属从盐酸中置换1molH2,发生转移的电子数为2NA
C.t℃时,1?L?pH=6的纯水中,含有1×10-6NA个OH-
D.标准状况下,11.2?L四氯化碳所含分子数为0.5NA
参考答案:D
本题解析:分析:A、质量换算物质的量计算;
B、依据氧化还原反应电子守恒计算金属做还原剂失电子,氢元素原子得到电子生成氢气;
C、水电离平衡中 氢氧根离子和氢离子浓度相同;
D、标准状况,四氯化碳不是气体.
解答:A、48gO3气体物质的量为1mol,含有NA个O3分子,故A正确;
B、常温常压下,活泼金属从盐酸中置换1molH2,金属做还原剂失电子,氢元素原子得到电子生成氢气,发生转移的电子数为2NA,故B正确;
C、t℃时,1 L pH=6的纯水中,水电离平衡中 氢氧根离子和氢离子浓度相同;含有1×10-6NA个OH-,故C正确;
D、标准状况,四氯化碳不是气体,11.2 L四氯化碳物质的量不是0.5mol,故D错误;
故选D.
点评:本题考查了阿伏伽德罗常数的应用,主要考查质量换算物质的量量计算微粒数,氧化还原反应电子守恒计算应用,水的电离特征,气体摩尔体积的条件应用,题目较简单.
本题难度:一般