1、实验题 如何防止铁的锈蚀是工业上研究的重点内容。为研究铁锈蚀的影响因素,某同学做了如下探究实验:
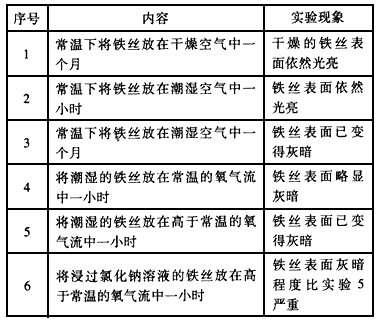
?回答以下问题:
(1)上述实验中发生了电化学腐蚀的是________(填实验序号) ;在电化学腐蚀中,负极反应是_____________;正极反应是______________;
(2)由该实验可知,可以影响铁锈蚀速率的因素是_____________;
(3)为防止铁的锈蚀,工业上普遍采用的方法是_______________ (答两种方法)。
参考答案:(1)3、4、5、6? ;2Fe-4e-=2Fe2+? ;2H2O+ O2+4e-=4OH-
(2)湿度、温度、O2的浓度、电解质存在
(3)电镀、发蓝等表面覆盖保护层法,牺牲阳极的阴极保护法等
本题解析:
本题难度:一般
2、选择题 如图甲池和乙池中的四个电极都是惰性材料,请根据图示判断下列说法正确的是( )

A.两个装置之间没有盐桥,故不能形成电流
B.a电极的电极反应式:C2H5OH+16OH--12e-=2CO+11H2O
C.一段时间后,乙池d电极周围的溶液呈现棕褐色
D.乙池在反应前后溶液的pH不变
参考答案:B
本题解析:图示是原电池与电解池的联合装置,不需要盐桥就能形成电流,选项A错;乙醇作还原剂,失电子,发生氧化反应,选项B正确;乙池中,阳极反应式:2I--2e-=I2,c电极为阳极,生成单质碘,故c电极周围的溶液呈棕褐色,选项C错;d电极作阴极,阴极反应式:2H2O+2e-=H2↑+2OH-,故乙池溶液的pH增大,选项D错。
本题难度:一般
3、选择题 下列叙述不正确的是( )
A.铁表面镀一层锌,铁件应连接电源的正极
B.船底镶嵌锌块,锌作负极,以防船体被腐蚀
C.金属的电化学腐蚀比化学腐蚀更普遍
D.炒过菜的铁锅未清洗易生锈
参考答案:A、铁表面镀一层锌,金属锌为阳极金属,和电源的正极相连,金属铁应为阴极金属,和电源的负极相连,故A错误;
B、在锌、铁原电池中,较活泼的金属锌往往做负极,负极金属易被腐蚀,正极金属可以被保护,故B正确;
C、金属的腐蚀以电化学腐蚀为主,电化学腐蚀比化学腐蚀更普遍,故C正确;
D、金属铁生锈的条件:和水以及氧气接触,炒过菜的铁锅容易发生吸氧腐蚀,故D正确.
故选A.
本题解析:
本题难度:简单
4、填空题 有一种节能的氯碱工业新工艺,将电解池与燃料电池相组合,相关流程如图所示(电极未标出):
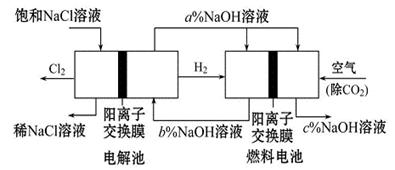
回答下列有关问题:
(1)通入空气的电极为 ?(写电极名称)。燃料电池中阳离子的移动方向?(“从左向右”或“从右向左”)。
(2)电解池中产生20 mol Cl2,理论上燃料电池中消耗?mol O2。
(3)a、b、c的大小关系为:?。
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池放电时正极反应式是?。
参考答案:(1)正极?从左向右?(2)10?(3)c>a>b?
(4) NiO(OH)+H2O+ e-= Ni(OH)2+ OH-
本题解析:分析题给装置图知,该装置是以碱性氢氧燃料电池电解饱和食盐水的装置;(1)根据燃料电池的工作原理:负极是燃料氢气发生失电子的氧化反应,正极是氧气发生得电子得还原反应,则通空气的电极为正极;原电池中,阳离子交换膜使阳离子通过,阳离子移向正极,从左向右;(2)电解池中产生20mol Cl2,依据电子守恒,结合电极反应式O2+4e-+2H2O=4OH-,4Cl--4e-=2Cl2↑,计算得到生成氧气10mol;(3)燃料电池中的离子膜只允许阳离子通过,而燃料电池中正极氧气得到电子产生OH-,所以反应后氢氧化钠的浓度升高,即a%小于c%,负极氢气失电子生成氢离子消耗氢氧根离子,所以b%<a%,得到b%<a%<c%,即c>a>b;(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,镍元素的化合价由+3价降为+2价,发生还原反应,作正极,电极反应式为NiO(OH)+H2O+ e-= Ni(OH)2+ OH-。
本题难度:一般
5、选择题 下列现象与电化学腐蚀无关的是( )
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.生铁比软铁心(几乎是纯铁)容易生锈
C.铁制器件附有铜质配件,在接触处易生锈
D.银质奖牌在空气中久置后表面变暗
参考答案:A、铜锌合金在电解质溶液中形成原电池反应,锌做负极被腐蚀.正极被保护,所以不易形成铜绿;和电化学有关,故A不符合;
B、生铁中含有碳,在电解质溶液中形成原电池反应,铁做原电池的负极发生氧化反应被腐蚀;所以容易生锈,故B不符合;
C、铁和铜接触处和电解质溶液会形成原电池反应,铁做负极发生氧化反应被腐蚀,故C不符合;
D、银在空气中被氧气氧化发生化学腐蚀;和电化腐蚀无关,故D符合;
故选D.
本题解析:
本题难度:一般