1、填空题 钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁
年产量的1/4。
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式。
正极:?;负极:?。
(2)为了降低某水库的铁闸门被腐蚀的速率,可以采用下图所示甲的方案,其中焊接在铁闸门的固体材料R可以采用?。(请写出具体金属名称)
(3)下图中乙方案也可降低铁闸门腐蚀速率,其中铁闸门应该连接在直流电源
的?极。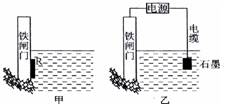
参考答案:(1)正极:O2+2H2O+4e-=4OH—;负极:Fe-2e-=Fe2+。(2) 锌 (3)负
本题解析:略
本题难度:简单
2、填空题 某兴趣小组采用如下方法制作氢氧燃料电池。

(1)如图A所示:a、b均为多孔石墨棒(多孔石墨棒,可吸附并储存生成的气体),其中a与直流电源正极相连,b与直流电源负极相连,电解质溶液为NaOH溶液,则a电极上发生的电极反应式为_________________,电解后溶液的pH____________(填“增大”、“减小”或“不变”)。
(2)然后如图B所示,移走直流电源,在a、b极间连接一个发光二极管,可以看到二极管发光。此时的电流方向是______________(填“a→b”或“b→a”),b极的电极反应式为______________________________ _。
(3)假设a极吸收22.4L(标准状况)气体,能量转化率为60%,则通过二极管的电子的物质的量为______________。
参考答案:(1)4OH--4e-=2H2O + O2↑(3分)?增大(2分)
(2)a→b?(2分) ?H2+2OH--2e-=2H2O(3分)? (3)2.4mol(2分)
本题解析:(1)a与直流电源正极相连,则a电极是阳极,所以溶液中的OH-放电生成氧气,电极反应式是4OH--4e-=2H2O + O2↑。惰性电极电解氢氧化钠溶液,相当于是电解水,所以氢氧化钠溶液的浓度增大,pH升高。
(2)由于a电极生成氧气,b电极生成氢气,所以此时是氢氧燃料电池,其中a是正极,b是负极,因此电流的方向是a→b;电解质是氢氧化钠溶液,所以负极电极反应式是?H2+2OH--2e-=2H2O。
(3)氧气的物质的量是1mol,在反应中得到4mol电子,由于能量的转化率是60%,因此通过二极管的电子的物质的量是4mol×60%=2.4mol。
点评:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。而在电解池中阳极失去,阴极得到电子,如果是惰性电极,则阳极是溶液中的阴离子失去电子,阴极是溶液中的阳离子得到电子,据此可以判断。
本题难度:一般
3、填空题 (共8分)中国是世界上最早研究和生产合金的国家之一。合金是被广泛使用的金属材料。
(1)金属腐蚀的现象非常普遍。造成钢铁腐蚀的主要原因是?腐蚀,其负极反应式为?。请例举两种防止铁制品被腐蚀的方法?、?。
(2)钢一般可分为碳素钢和?两大类。根据含碳量的不同,碳素钢可分为?、?和?。
参考答案::(1)电化学、Fe – 2e- = Fe2+、涂油漆、镀金属保护层等(其它合理答案均可);
(2)合金钢、高碳钢、中碳钢、低碳钢
本题解析:电化学腐蚀:不纯的金属或合金与电解质溶液接触,会发生原电池反应,比较活泼的金属失电子被氧化的腐蚀。金属腐蚀主要以电化学腐蚀为主。腐蚀时,负极反应:Fe – 2e- = Fe2+
要想减少或避免金属腐蚀,可采取措施:
①对金属做必要的精炼,以减少其中能导电的不活泼杂质。
②对机器、仪表及时保养,减少金属与腐蚀性气体、电解质溶液、潮湿气体的接触。
③根据用途不同采取不同的方法使金属与造成发生的介质隔离,如涂油脂、喷漆、镀层、表面钝化等。
④选用适宜的金属或非金属制成耐腐蚀的合金,如炼制不锈钢、耐酸钢等。
⑤采用电化学防护方法,如在钢铁的船体上焊接上较活泼的金属锌。
点评:此题考查了金属的腐蚀原因、分类以及保护。铁合金的分类。
本题难度:一般
4、填空题 (11分)按下图装置进行实验,并回答下列问题
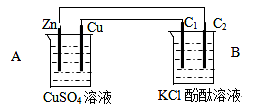
⑴判断装置的名称:A池为__________池,B池为___________池。
⑵铜极为__________极,电极反应式为??,
石墨棒C1为______极,电极反应式为________________________?,
石墨棒C2附近发生的实验现象为______________________________?。
⑶当C2极析出224mL气体(标准状态)时,左侧烧杯中溶液的质量_________(增加、不变或减少)_________g。
参考答案:(11分)(电极反应每个2分,其余每空1分)
⑴原电,?电解。
⑵正,Cu2+ + 2e—=Cu;?阳,2Cl—+2e—= Cl2↑;?溶液变红色。
⑶增加? 0.01
本题解析:(1)由图示可知A池是锌铜原电池,做为电源电解B池,连接Zn负极的C2电极为阴极,连接Cu正极的C1电极为阳极。
(2)
A池为原电池:Zn + Cu2+==Zn2+ + Cu
负极:Zn-2e-=Zn2+?正极:Cu2++2e-=Cu
B池为原电池:2KCl+2H2O =2KOH+H2↑+Cl2↑
阴极:2H++2e-=H2↑?阳极:2Cl—+2e—= Cl2↑
在阴极由于氢离子的放电,导致溶液呈碱性,酚酞呈红色。
(3)原电池中每进入1 molZn而析出1 molCu,故溶液的质量增加65-64 =" 1" g
H2? ~? 2e-? ~?△m
1mol? 1 g
0.01mol? 0.01g
本题难度:一般
5、填空题 (15分)a、b、c、d、e为短周期主族元素。其中
①a和b属同周期元素,二者能形成多种气态化合物;
②a和c属同周期元素,二者能形成两种气态化合物;
③a和d属同主族元素,二者能形成两种常见化合物;
④e可分别和a、b、c、d形成具有相同电子数的共价化合物甲、乙、丙、丁。
请回答:
(1)a元素为____?,甲的分子式为?,丁的电子式为?。
(2)由上述一种或几种元素形成的物质可与水发生氧化还原反应,写出一个符合要求的化学反应方程式:?。
(3)a单质和丙可形成燃料电池(以KOH溶液为电解质)。该燃料电池的负极反应式为
?。
(4)乙是一种液态火箭燃料,在O2中燃烧,产物无污染。常温下,6.4 g乙燃烧放出QkJ热量,该反应的热化学方程式为____?。
参考答案:(15分)
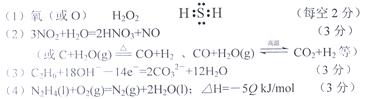
本题解析:略
本题难度:一般