1、选择题 家用炒菜铁锅用水清洗后,放置一会出现红棕色的铁锈,在此变化过程中不会发生的化学变化是(?)
A.2Fe+ O2 + 2H2O=2Fe(OH)2
B.4Fe(OH)2+O2 +2H2O=4Fe(OH)3
C.O2 + 2H2O + 4e-→ 4OH-
D.Fe → Fe3++3e-
参考答案:D
本题解析:之所以出现红棕色的铁锈,是因为铁发生电化学腐蚀,铁作负极失去电子被氧化生成亚铁离子,在电化学中铁不可能直接生成Fe3+。答案是D。
本题难度:一般
2、选择题 已知电池总反应为:Zn+2MnO2+H2O ZnO+2MnO(OH)。下列说法正确的是
ZnO+2MnO(OH)。下列说法正确的是
A.放电时,Zn为负极,ZnO为正极,MnO2为催化剂
B.放电时,该电池的正极反应为:MnO2+e-+H2O=MnO(OH)+OH-
C.充电时,电池将化学能转为电能
D.放电时,溶液中的阴离子向原电池的正极移动
参考答案:B
本题解析:放电时,Zn为负极,MnO2为正极,A错误;放电时正极发生还原反应,B正确;充电时电能转变为化学能,C错误;放电时阴离子向负极移动,D错误。答案选B。
点评:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应,据此可以进行有关的判断。
本题难度:一般
3、选择题 有关下图的说法正确的是(? )
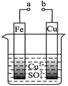
A.a和b连接构成原电池,溶液中SO42-移向Cu极
B.a和b连接构成原电池,Cu极上发生还原反应
C.a、b分别接直流电源正、负极,电子从Cu片流向b
D.a、b分别接直流电源正、负极,可以在Fe片上镀Cu
参考答案:B
本题解析:如图若a和b连接,则该装置形成原电池,则Fe做负极,失去电子被氧化,溶液中SO42-向负极移动;Cu做正极,Cu2+得到电子被还原,溶液中Cu2+向正极移动,所以A错误,B正确;若a、b分别接直流电源正、负极,则该装置形成了电解池,Fe做阴极,Fe失去电子发生氧化反应被溶解,Cu作阳极,Cu2+得到电子在铜片上析出铜,所以C、D均错误;故选B。
本题难度:一般
4、选择题 能够反应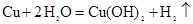 发生的是
发生的是
A.铜片作负极,碳棒作正极,氯化钠作电解质溶液
B.铜锌合金在潮湿空气中发生电化学腐蚀
C.用铜片作阴、阳电极,电解硫酸铜溶液
D.用铜片作阴、阳电极,电解硫酸钠溶液
参考答案:D
本题解析:该反应不能自发进行,只能依靠外加能量才能实现,故应采用电解原理的方法,排除AB(原电池);反应中铜失电子,应做电解池的阳极,排除C;选项D完全符合题意
本题难度:一般
5、选择题 下列对金属制品采取的防护方法不正确的是( )
A.在电线的外面包上一层塑料层
B.喷涂油漆
C.在海轮的铁制外壳上焊上铜块
D.在轮船的外表面焊上一些锌块
参考答案:A.外面包上一层塑料层可减少与空气中氧气的接触,故A正确;
B.喷涂油漆可以隔绝空气,使金属不受腐蚀,故B正确;
C.原电池能加快化学反应速率,铁铜海水构成原电池,铁做负极加快铁的腐蚀,故C错误;
D.在轮船的外表面焊上一些锌块,铁锌海水形成原电池反应,铁做正极被保护,故D正确;
故选C.
本题解析:
本题难度:一般