1、选择题 关于反应:RO3—+(?)+6H+?3R2↑+3H2O的下列说法中,正确的是?(?)
A.R一定是周期表中的第VA族元素
B.RO3—中的R元素在该反应中被氧化
C.R是同周期元素中原子半径最大的元素
D.上式括号中所填物质在反应中作还原剂
参考答案:B
本题解析:略
本题难度:一般
2、选择题 某元素的一种同位素X原子的质量数为A,含N个中子,它与1H原子组成HmX分子,在ag HmX分子中含质子的物质的量是(? )
A.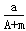 (A+N+m)mol
(A+N+m)mol
B.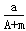 (A-N+m)mol
(A-N+m)mol
C.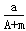 ( A-N)mol
( A-N)mol
D.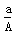 (A-N)mol
(A-N)mol
参考答案:B
本题解析:X原子的质量数为A,含N个中子,则质子数是A-N。所以它与1H原子组成HmX分子中质子数=A-N+m,则在ag HmX分子中含质子的物质的量是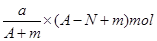 ,答案选B。
,答案选B。
点评:该题是基础性试题的考查,试题贴近高考,难易适中,有利于培养学生分析问题、以及灵活运用基础知识解决实际问题的能力。该题的关键是明确组成原子的微粒之间的关系,然后具体问题、具体分析即可,难度不大。
本题难度:一般
3、选择题 下列各组微粒具有相同的质子数和电子数的是(?)
A.CH4、NH3、H2
B.OH-、F-、Ne
C.H3O+、NH4+、Na+
D.O2-、F-、Mg2+
参考答案:C
本题解析:CH4、NH3、H2的质子数分别为10,10、2,电子数分别为10,10、2,故A错误;OH-、F-、Ne的质子数分别为9、9、10,电子数分别为10、10、10,故B错误;H3O+、NH4+、Na+的质子数都是11、电子数都是10,故C正确;O2-、F-、Mg2+的质子数分别为8、9、12,电子数都是10,故D错误,答案选C。
点评:该题是基础性试题的考查,难度不大。明确质子数和电子数的计算及中性微粒中质子数等于电子数是解答本题的关键,有利于培养学生的逻辑思维能力和发散思维能力。
本题难度:一般
4、选择题 A、B为同主族的两元素,A在B的上一周期,若A的原子序数为n,则B的原子序数不可能为
A.n+8? B.n+18? C.n+32? D.n+20
参考答案:D
本题解析:略
本题难度:简单
5、选择题 已知X为第三周期元素的原子,该原子要达到8电子稳定结构,则需要的电子数小于其次外层和最内层的电子数之差,且等于最内层电子数的整数倍。下列说法正确的是(?)
A.X元素最高价氧化物对应的水化物一定是强酸
B.X元素的氢化物的化学式一定为H2X
C.X的单质一定是良好的半导体材料
D.X元素的氧化物一定能与烧碱反应
参考答案:D
本题解析:第三周期元素的次外层有8个电子,最内层有2个电子,二者之差为6。因为该原子达到8电子稳定结构需要的电子数小于6,则需要的电子数为2或4。若为2,则X为S;若为4,则X为Si,硅酸为弱酸,A错;硅的氢化物为SiH4,B错;S单质不能作半导体材料,C错;SO2、SO3和SiO2都能与烧碱反应,D正确。
本题难度:一般