1、选择题 在铁的电化学腐蚀中,发生还原反应的那个电极上进行的电极反应是( )
A.2H2O+O2+4e-═4OH-
B.2H++2e-═H2
C.4OH--4e-═2H2O+O2
D.Fe-2e-═Fe2+
参考答案:根据原电池工作原理,在铁的电化学腐蚀中,活泼的金属铁作负极,不如铁活泼的金属或导电的非金属作正极,所以铁作负极,正极上得电子发生还原反应,钢铁发生吸氧腐蚀时,正极上氧气得电子和水反应生成氢氧根离子,即2H2O+O2+4e-═4OH-,发生析氢腐蚀时,正极上是氢离子得电子的反应,即2H++2e-═H2,负极失电子变成离子进入溶液,即Fe-2e-=Fe2+.
故选AB.
本题解析:
本题难度:简单
2、选择题 分别放置在下图所示装置(都盛有0.1 mol·L-1的H2SO4溶液)中的四个相同的纯锌片,腐蚀最慢的是
参考答案:D
本题解析:A是锌的化学腐蚀,B和C中都是原电池,但由于金属性是镁>锌>锡,所以B中锌是正极被保护,属于牺牲阳极的阴极保护法。C中锌是负极,加快腐蚀。D中是电解池,锌和电源的负极相连,做阴极,被保护,属于外加电流的阴极保护法,因此腐蚀最慢的是D,答案选D。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生基础知识的巩固和训练,难度不大。该题的关键是明确金属腐蚀和防护的原理,然后结合题意具体问题、具体分析即可。
本题难度:一般
3、选择题 如图所示,将紧紧缠绕不同金属丝的铁钉放入培养皿中,再加入含有适量NaCl的溶液。下列叙述正确的是
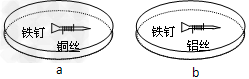
[? ]
A.a中铜丝上发生氧化反应
B.b中铁钉上发生还原反应
C.a、b中的铁钉均会发生锈蚀?
D.a、b中反应时均有氢气放出
参考答案:B
本题解析:
本题难度:一般
4、选择题 美国科学家找到了一种突破目前锂离子电池充电量和充电速度限制的方法,该方法将硅簇置入石墨烯层之间,达到提升电池内部锂离子密度的效果,这种材料制成的新型锂电池充电容量和效率都比普通锂电池提高近十倍,下列有关说法正确的是
A.电池工作时,锂电极为阳极,发生还原反应
B.电池充电时,Li+向阴极移动
C.该电池的化学能可完全转化为电能
D.新材料就是碳和硅化合而成的碳化硅材料
参考答案:B
本题解析: A、电池工作时,锂电极为负极,发生氧化反应,错误;B、充电时,阳离子Li+向阴极移动,正确;C、该电池化学能与电能的转化不可能完全,错误;D、新材料将硅簇置入石墨烯层,但不是碳化硅材料,错误。
本题难度:一般
5、填空题
|
对金属制品进行抗腐蚀处理,可延长其使用寿命。
(1)以下为铝材表面处理的一种方法
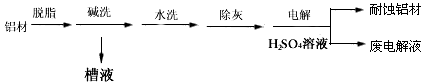
①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是___________________(用离子方程式表示)。为将碱洗槽液中铝以沉淀形式回收,最好向槽液中加入下列试剂中的___________。
a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应为_______________。取少量废电解液,加入NaHCO3,溶液后产生气泡和白色沉淀,产生沉淀的原因(用离子方程式表示)___________________________。
(2)利用如图装置,可以模拟铁的电化学防护。
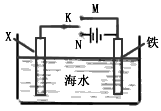
若X为碳棒,为减缓铁的腐蚀,开关K应置于______处。
若X为锌,开关K置于M处,该电化学防护法称为_______。
参考答案:(1)①2Al+2OH-+2H2O==2AlO2-+3H2↑;b
②2Al+3H2O-6e-==Al2O3+6H+;Al3++3HCO3-==Al(OH)3↓+3CO2↑
(2)N;牺牲阳极的阴极保护法
本题解析:
本题难度:一般